Für viele Familien in unserer Gemeinschaft beginnt die Reise mit einer seltenen genetischen Erkrankung mit einem einzigen, winzigen Fehler im Anleitungshandbuch des Körpers—unserer DNA. Wir wissen, dass das Verständnis der Wissenschaft hinter diesen Zuständen ein erster Schritt sein kann, um sich ermächtigt zu fühlen. Seit Jahrzehnten konzentrierten sich die Behandlungen auf die Linderung von Symptomen, anstatt die Ursache des Problems anzugehen. Aber heute möchten wir mit Ihnen durch eine Entwicklung gehen, die ein neues Kapitel der Hoffnung repräsentiert, eine Geschichte unglaublichen wissenschaftlichen Fortschritts, die zum Herzen dieser Erkrankungen vordringt.
Wir hören immer mehr von einer revolutionären Technologie namens in vivo Base Editing. Wir wissen, dass diese wissenschaftlichen Begriffe einschüchternd wirken können, daher ist es unser Ziel, es gemeinsam aufzuschlüsseln. Dies ist eine Geschichte darüber, wie wir von großen Veränderungen in unserer DNA zu unglaublich präzisen Veränderungen übergehen. Es geht um eine neue Art von "molekularem Bleistift", der einen sanfteren, zielgerichteten Ansatz bietet, um den ursprünglichen genetischen Tippfehler zu korrigieren.[1]
Dies ist ein tiefer Einblick in die Wissenschaft, die Hoffnung und die realistischen Herausforderungen dieser neuen Grenze. Wir glauben, dass wir, indem wir es verstehen, informiertere Gespräche führen, bessere Fragen stellen und gemeinsam mit einem klareren Gefühl dafür, was die Zukunft bringen könnte, vorwärts gehen können.
Von Molekularscheren zu einem genetischen Bleistift: Die Evolution der Genbearbeitung
Um den Durchbruch des Base Editing zu verstehen, hilft es, zuerst einen Blick auf die Technologie zu werfen, die ihm vorausging: CRISPR-Cas9. Sie haben vielleicht gehört, dass CRISPR als "molekulare Scheren" bezeichnet wird.[1] Es war eine revolutionäre Entdeckung, die es Wissenschaftlern ermöglichte, einen bestimmten Punkt in unserer DNA zu finden und einen Schnitt zu machen. Dies war ein monumentaler Fortschritt, der es den Forschern ermöglichte, fehlerhafte Gene „auszuschalten“. Diese Technologie ist die Grundlage für die erste genehmigte CRISPR-basierte Therapie bei Sichelzellenanämie, Casgevy, bei der Zellen aus dem Körper entnommen, mit diesen Scheren bearbeitet und dann an den Patienten zurückgegeben werden.
Obwohl es unglaublich mächtig ist, ist die Idee, einen Doppelstrang-Schnitt in unserer DNA zu machen, immer mit Herausforderungen verbunden gewesen. Der natürliche Reparaturprozess der Zelle für einen solchen Schnitt kann etwas unvorhersehbar sein und gelegentlich zu unbeabsichtigten Änderungen führen.[2] Wir wissen, dass für jede Therapie, die weit verbreitet eingesetzt werden soll, insbesondere im Körper, Sicherheit die höchste Priorität hat.
Hier kommt das Base Editing ins Spiel, das den nächsten Schritt auf dieser Reise des Fortschritts darstellt. Entwickelt von Forschern, darunter einem Team unter der Leitung von Dr. David Liu an der Harvard University und dem Broad Institute, wurde das Base Editing entwickelt, um mehr wie ein „molekularer Bleistift“ zu sein.[3][4] Es wurde geschaffen, um eine präzise Veränderung eines einzelnen Buchstabens des DNA-Codes vorzunehmen, ohne einen störenden Schnitt zu machen.[5][6]
So können wir uns dessen Funktionsweise vorstellen:
Der Leitfaden: Ein Molekül namens Leit-RNA (gRNA) fungiert wie ein GPS, das den Base Editor zu dem genauen, spezifischen "Tippfehler" in den Milliarden von Buchstaben, die unsere DNA ausmachen, führt.[1]
Der Anker: Der Base Editor verwendet ein deaktiviertes CRISPR-Eiweiß (oft als Nickase oder „tote“ Cas9 bezeichnet) als Anker. Es hält an der DNA an der richtigen Stelle fest, aber—und das ist der entscheidende Unterschied—es macht keinen Doppelstrangschnitt.[5][7]
Der Bleistift: An diesen Anker ist ein spezielles Enzym (eine Deaminase) gebunden, das als Bleistift fungiert. Es führt eine chemische Reaktion durch, die effektiv den falschen DNA-Buchstaben löscht und ihn durch den richtigen ersetzt.[7][8]
Die Schönheit dieses Ansatzes liegt in seiner Präzision und seiner sanften Natur. Durch das Vermeiden eines Schnitts umgeht es viele der Bedenken, die mit den ursprünglichen "molekularen Scheren" verbunden sind, und bietet eine potenziell sicherere Möglichkeit, die grundlegenden genetischen Fehler zu korrigieren, die so viele seltene Krankheiten verursachen.[1][9]
Die Lieferherausforderung: Den Bleistift auf die richtige Seite bringen
Einen erstaunlichen "genetischen Bleistift" zu haben, ist das eine, aber ihn in die richtigen Zellen tief im Körper zu bringen, ist eine der größten Herausforderungen in der gesamten Gentherapie.[2][10] Das ist der "in vivo"-Teil des Puzzles—die Änderungen im lebenden Körper vorzunehmen. Für die vielen Erkrankungen, die Organe wie die Leber, das Gehirn oder die Muskeln betreffen, ist dies der einzige Weg, wie eine gentherapeutische Behandlung wirken kann.
Wissenschaftler arbeiten unermüdlich an diesem Lieferproblem, und zwei Hauptansätze haben sich als führend herausgestellt. Denken Sie an sie als zwei verschiedene Arten von mikroskopischen Lieferfahrzeugen:
Viral Vektoren (wie AAVs): Dies sind im Wesentlichen die Schalen von Viren, die ausgehöhlt und so umgebaut wurden, dass sie keine Krankheiten verursachen können. Stattdessen sind sie mit den genetischen Anweisungen für die Herstellung des Base Editors gefüllt.
Der Vorteil: Viren sind von Natur aus sehr gut darin, in unsere Zellen einzudringen, und verschiedene Typen von Adeno-assoziierten Viren (AAVs) sind dafür bekannt, spezifische Gewebe wie die Muskeln oder die Augen anzusprechen.[11] Sie haben eine lange Erfolgsbilanz in der Forschung zur Gentherapie.
Die Herausforderungen: Wir wissen, dass unsere Körper darauf ausgelegt sind, Viren abzuwehren. Das bedeutet, dass viele Menschen eine bereits bestehende Immunität haben, die den Vektor stoppen könnte, bevor er seine Aufgabe erfüllt.[12][13] Diese Immunreaktion macht es auch schwierig, eine zweite Dosis zu verabreichen.[12] Außerdem haben AAVs einen begrenzten "Laderaum" von etwa 4,7 Kilobasen, was für die Basisbearbeitungsmaschine eine enge Passung sein kann.[14][15]
Lipid-Nanopartikel (LNPs): Vielleicht haben Sie von diesen in den mRNA-COVID-19-Impfstoffen gehört. LNPs sind winzige, konstruierte Bläschen aus Fett, die die genetischen Anweisungen (in Form von mRNA) für den Basiseditor transportieren können.[16][17]
Der Vorteil: LNPs haben einen größeren Laderaum und sind weniger wahrscheinlich, eine starke Immunreaktion auszulösen, was bedeutet, dass eine nachfolgende Dosis möglich sein könnte.[2][16] Ein großer Sicherheitsvorteil ist, dass sie vorübergehende Anweisungen liefern. Die Zelle stellt den "Bleistift" her, erfüllt seine Aufgabe und dann werden die Anweisungen und der Bleistift natürlich abgebaut. Dieses kurze Fenster der Aktivität verringert das Risiko unerwünschter Änderungen.[18]
Die Herausforderungen: Zurzeit werden die meisten LNPs, die intravenös verabreicht werden, natürlicherweise von der Leber aufgenommen.[19][20] Während dies perfekt ist, um Lebererkrankungen zu behandeln, arbeiten Forscher hart daran, neue LNPs zu entwickeln, die auf andere Gewebe im Körper geleitet werden können.[16]
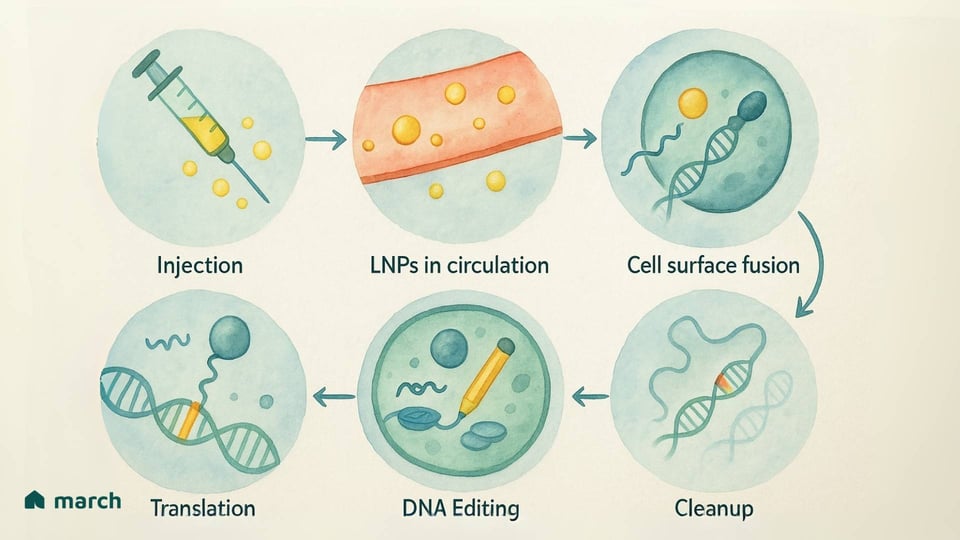
Der Fortschritt bei diesen Liefersystemen ist ebenso wichtig wie die Bearbeitungswerkzeuge selbst. Jeder Schritt nach vorne, um diese "Lastwagen" sicherer und zielgerichteter zu machen, ist ein Schritt nach vorne für unsere Gemeinschaft.
Ein Meilenstein: Der erste Mensch, der in vivo Base Editing erhielt
Über Jahre hinweg war diese Technologie Gegenstand hoffnungsvoller Forschungen in Laboren. Doch kürzlich erlebten wir einen Meilenstein, der sie von der Theorie in die Realität überführte. Die Geschichte von K.J. Muldoon, einem Baby, das mit einer schweren und lebensbedrohlichen seltenen genetischen Erkrankung geboren wurde, war eine unglaubliche Inspirationsquelle.
K.J. wurde mit einem Mangel an Carbamoylphosphatsynthetase 1 (CPS1) diagnostiziert, einer seltenen Stoffwechselerkrankung, bei der die Leber Ammoniak, ein toxisches Nebenprodukt des Abbaus von Proteinen, nicht verarbeiten kann.[21][22] Diese Erkrankung kann verheerend sein, mit einer geschätzten Sterblichkeitsrate von 50 % im frühen Säuglingsalter.[23] Wir kennen die Angst und Unsicherheit, die mit einer solchen Diagnose einhergehen.
Aber K.J.s spezifische Erkrankung wurde durch einen einzigen Buchstabenfehler in seiner DNA verursacht—ein perfekter Kandidat für das Base Editing. In einem bemerkenswerten Aufwand wurde eine personalisierte Therapie speziell für ihn in nur sechs Monaten entwickelt.[21] Er erhielt eine intravenöse Infusion eines LNP—der winzigen Fettblase—die die mRNA-Anweisungen für einen Base Editor "Bleistift" trug, der darauf ausgelegt war, seine genaue Mutation zu beheben.[24][25]
Die frühen Ergebnisse haben Hoffnung gegeben:[23]
K.J. begann, mehr Protein in seiner Ernährung zu tolerieren.
Die Dosis der Medikamente, die er benötigte, um seine Ammoniakwerte zu kontrollieren, wurde erheblich reduziert.
Er begann, seine Entwicklungsschritte zu erreichen.
Am mächtigsten war, dass er in der Lage war, zwei gängige Kinderkrankheiten zu überwinden, ohne in eine lebensbedrohliche Krise zu geraten, etwas, das vorher vor der Therapie fast sicher gewesen wäre.
Wir müssen diesen Weg sowohl mit Hoffnung als auch mit Realität gehen. Dies war eine Therapie für ein mutiges Kind, und wir müssen noch beobachten, wie lange die Korrektur anhält.[23] Aber diese einzelne Geschichte ist ein kraftvoller Beweis für das Konzept. Sie zeigt, dass diese Technologie möglich ist und das Potenzial hat, Leben zu verändern. Sie öffnet auch die Tür zu einer Zukunft, in der Therapien auf die einzigartige genetische Zusammensetzung eines Individuums zugeschnitten werden können.[24]
Dies ist nicht nur eine Geschichte. Die Forschung für andere Erkrankungen wird aktiv fortgesetzt. In Labor-Modellen von Progerie, einer Krankheit des vorzeitigen Alterns, hat das Base Editing den genetischen Tippfehler korrigiert und die Lebensdauer der Mäuse dramatisch verlängert. Klinische Studien, die das Base Editing verwenden, sind ebenfalls im Gange für Erkrankungen wie hohe Cholesterinwerte (geführt von Verve Therapeutics) und Alpha-1-Antitrypsin-Mangel (geführt von Beam Therapeutics).[26][27] Diese Welle der Forschung wird durch die Bedürfnisse vieler verschiedener Patientengruppen vorangetrieben, und jeder Erfolg schafft Schwung für den nächsten.
Gemeinsam vorwärts: Der Weg, der vor uns liegt
Die Morgendämmerung des in vivo Base Editing ist unglaublich aufregend, aber als Gemeinschaft wissen wir, dass Fortschritt verantwortungsbewusst und transparent gemacht werden muss. Es gibt noch erhebliche Herausforderungen zu bewältigen, und es ist wichtig, dass wir offen darüber sprechen.
Sicherheit hat immer Vorrang: Die oberste Priorität besteht darin, sicherzustellen, dass der "Bleistift" nur den beabsichtigten DNA-Buchstaben bearbeitet und sonst nichts. Wissenschaftler haben strenge Methoden entwickelt, um diese "Off-Target"-Änderungen zu überprüfen, und arbeiten ständig daran, die Werkzeuge noch präziser zu machen.[9][28]
Langfristige Auswirkungen verstehen: Für jede Therapie, die eine dauerhafte Veränderung vornimmt, müssen wir Patienten sehr lange verfolgen, um sicherzustellen, dass die Nutzen dauerhaft sind und keine unerwarteten Probleme auftreten.[10][29]
Die Herausforderung des Zugangs: Wir wissen, dass diese fortschrittlichen Therapien derzeit unglaublich komplex und kostspielig in der Herstellung sind, wobei einige Gentherapien über 2 Millionen Dollar pro Behandlung kosten.[30][31][32] Es ist für unsere Gemeinschaft von entscheidender Bedeutung, dass wir uns für eine Zukunft einsetzen, in der diese lebensverändernden Behandlungen für alle, die sie benötigen, zugänglich sind, unabhängig davon, wo sie leben oder über welche Ressourcen sie verfügen.[33] Dies ist ein Gespräch, das wir jetzt führen müssen, ganz am Anfang.
Das Feld steht nicht still. Wissenschaftler entwickeln bereits die nächste Generation von Tools, wie das Prime Editing, eine weitere Innovation aus Dr. Lius Labor, die wie eine "Suche und Ersetzen"-Funktion für DNA funktioniert und sogar mehr Arten genetischer Fehler beheben kann, einschließlich kleiner Einfügungen und Löschungen.[34][35][36][37][38][39]
Wenn wir diese neue Grenze der Medizin beobachten, verpflichten wir uns, Ihnen klare, vertrauenswürdige Informationen zu liefern. Wir werden die Durchbrüche feiern und ehrlich über die Herausforderungen sein. Wir werden weiterhin eine Gemeinschaft aufbauen, in der wir lernen, teilen und uns gegenseitig unterstützen können. Ihre Einsichten, Ihre Erfahrungen und Ihre Hoffnung sind es, was diesen Vorwärtsmarsch vorantreibt. Auf dieser Reise der Entdeckung sind Sie nicht allein.
Für eine schnelle Übersicht, schauen Sie sich unsere neue Podcast-Folge an, die die Geschichte und Wissenschaft dieser Therapie erkundet.
https://youtu.be/-aVHZciahbw
Quellen
[7] Menichiello, T. (2023, 27. September). Base Editing und Prime Editing: Wie sie die Gentherapie verändern. Cell & Gene.
[30] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024). Preiswerte Preise für CRISPR-Behandlungen sind ein drängendes ethisches Imperativ. CRISPR Journal.
[1] BioTechniques. (2017, 1. November). Molekulare Bleistifte verändern Basen.
[40] Verve Therapeutics. (2025). VERVE-102. Abgerufen von vervetx.com.
[31] Glick, B. (2023, 8. Dezember). Teure neue Gentherapien für Sichelcellanämie stellen einen Zugangstest dar. BioPharma Dive.
[33] CRISPR Therapeutics Kanada. (2025, 28. Januar). Die tatsächlichen Kosten der CRISPR-Behandlung: Was kanadische Patienten wissen müssen.
[8] Genethique. (2017, 2. November). ABE (Adenin-Basen-Editor): ein "Baseneditor", um das CRISPR-Werkzeugkasten zu vervollständigen.
[21] Technology Networks. (2025, 27. Juni). Wie die erste maßgeschneiderte Gentherapie in 6 Monaten geschaffen wurde.
[2] Open Access Journals. (o.D.). Probleme, mit denen Ärzte in der Gentherapie konfrontiert sind. Journal of Gene Therapy.
[41] Rare Disease Advisor. (2025, 15. April). Verve Therapeutics berichtet von vielversprechenden Ergebnissen für PCSK9-Gene Editing in HeFH.
[12] Biocompare. (2025, 2. Januar). Herausforderungen überwinden in AAV- und rAAV-basierten Gentherapien.
[32] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024, 14. Oktober). Preiswerte Preise für CRISPR-Behandlungen sind ein drängendes ethisches Imperativ. ResearchGate.
[10] Consensus. (o.D.). Was sind die Herausforderungen bei der Entwicklung von Gentherapien für genetische Störungen?
[14] Form Bio. (o.D.). Die Rolle von AAV in der Gentherapie.
[22] Sanders, R. (2025, 15. Mai). Ein Säugling, der mit einer tödlichen Krankheit geboren wurde, gedeiht jetzt dank einer maßgeschneiderten CRISPR-Behandlung sechs Monate nach der Geburt. Berkeley News.
[5] Ma, Y., et al. (2023). Präzises Genom-Editing mit Baseneditoren. Journal of Genetics and Genomics.
[34] Howard Hughes Medical Institute. (2020, 12. Juni). Präzises Genom-Editing betritt das moderne Zeitalter.
[9] MedNexus. (2024). Zielgerichtete Gentherapie: Versprechen und Herausforderungen bei der Krankheitsbewältigung. Journal of Bio-X Research.
[15] BioInnovatise. (2024, 9. Dezember). Ressourcen für die Verpackungskapazität von AAV.
[24] Ahn, N. (2025, 22. Mai). Penn Med, CHOP-Forscher behandeln ein Kind mit der weltweit ersten personalisierten Gentherapie. The Daily Pennsylvanian.
[28] Frontiers in Pediatrics. (2024). Fortschritte und Herausforderungen in Strategien zur Gentherapie für pädiatrische Krebserkrankungen: ein umfassendes Update.
[35] Rett Syndrome Research Trust. (o.D.). Prime Editing.
[29] Patsnap. (2025, 20. März). Was sind die ethischen Herausforderungen in der Gentherapie?
[26] Taylor, N.P. (2025, 5. Mai). 'Sicherer' CRISPR: Base Editing bricht in der Klinik durch, während Beam und Verve vorankommen. BioSpace.
[36] Cross, R. (2019, 2. Dezember). Einführung von CRISPR 3.0. C&EN Global Enterprise.
[23] Garcia de Jesus, E. (2025, 28. Mai). Personalisierte Genbearbeitung hat ein Baby gerettet, aber die Zukunft der Technik ist ungewiss. Science News.
[37] Synthego. (o.D.). Prime Editing als präzises Werkzeug für die Genbearbeitung.
[6] SCMP. (2023, 31. Mai). Chinesische Wissenschaftler entwickeln neues Werkzeug zur Genbearbeitung, das sich von CRISPR-Cas9 unterscheidet.
[27] DeFeudis, N. (2025, 11. März). Beam teilt vielversprechende erste klinische Daten zur Behandlung der Lungen- und Lebererkrankung. Endpoints News.
[42] Wu, G. (2025, 24. März). Verve erhält grünes Licht von der FDA, um die Basisbearbeitung in den USA auszudehnen. BioPharma Dive.
[3] Broad Institute. (2025, 5. April). David Liu erhält den Breakthrough Prize in Life Sciences.
[4] Howard Hughes Medical Institute. (2025, 5. April). David Liu erhält den Breakthrough Prize.
[43] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024). Preiswerte Preise für CRISPR-Behandlungen sind ein drängendes ethisches Imperativ. Digital CSIC.
[13] High, K. A., & Roncarolo, M. G. (2019). Immunantworten auf AAV-Vektoren: Überwinden von Barrieren für erfolgreiche Gentherapie. Molecular Therapy.
[38] O'Hanlon Cohrt, K. (2023, 4. Dezember). Erklärer: Was ist Prime Editing und wofür wird es verwendet?. CRISPR Medicine News.
[44] O'Hanlon Cohrt, K. (2025, 14. Mai). Die neuesten Updates zu klinischen Studien von CRISPR Medicine News.
[16] GenScript. (2024, 15. Oktober). Lipid-Nanopartikel: Ein Durchbruch bei CRISPR-Liefersystemen.
[39] Davies, H., & Auguste, A. (2023). Basis- und Prime-Genome-Editing in der präzisen Onkologie. Cancer Research.
[11] Revvity. (o.D.). AAV-Vektoren: Herausforderungen und Lösungen für die Herstellung von Gentherapien.
[45] Verve Therapeutics. (2025, 14. Mai). Verve Therapeutics kündigt Fortschritte in der Pipeline an und berichtet über die Ergebnisse des ersten Quartals 2025.
[46] CRISPR Medicine News. (2025, 11. März). Beam Therapeutics berichtet über klinische Proof-of-Concept-Daten für BEAM-302 in der Alpha-1-Antitrypsin-Mangelstudie.
[47] Verve Therapeutics. (2025, 11. April). Verve Therapeutics erhält die US-FDA Fast-Track-Zulassung für VERVE-102, ein in vivo Base Editing-Medikament, das auf PCSK9 abzielt.
[48] Beam Therapeutics. (2025, 10. März). Beam Therapeutics kündigt positive erste Daten für BEAM-302 in der Phase 1/2-Studie zu Alpha-1-Antitrypsin-Mangel (AATD) an, die die erste klinische genetische Korrektur einer krankheitsverursachenden Mutation demonstriert.
[25] Children's Hospital of Philadelphia. (2025, 15. Mai). Der weltweit erste Patient mit personalisierter CRISPR-Gentherapie im Children's Hospital of Philadelphia behandelt.
[17] ACS Publications. (2022, 20. Mai). Lipid-Nanopartikel-basierte Lieferung von CRISPR/Cas9-Genom-Editing-Komponenten.
[18] PubMed Central (PMC). (o.D.). Lipid-Nanopartikel: Der Game-Changer bei CRISPR-Cas9-Genom-Editing.
[49] Promega Connections. (2025, 28. Mai). Brillanz beim Base Editing: Der Durchbruchspreis von David Liu und seine Auswirkungen.
[19] Nano Magazine. (2022, 19. Dezember). Lipid-Nanopartikel-vermittelte Lieferung von CRISPR-Komponenten für neuronales Genom-Editing.
[20] ACS Nanoscience Au. (2023, 30. März). Aktuelle Fortschritte in der spezifischen Lipid-Nanopartikel-Lieferung für mRNA.









