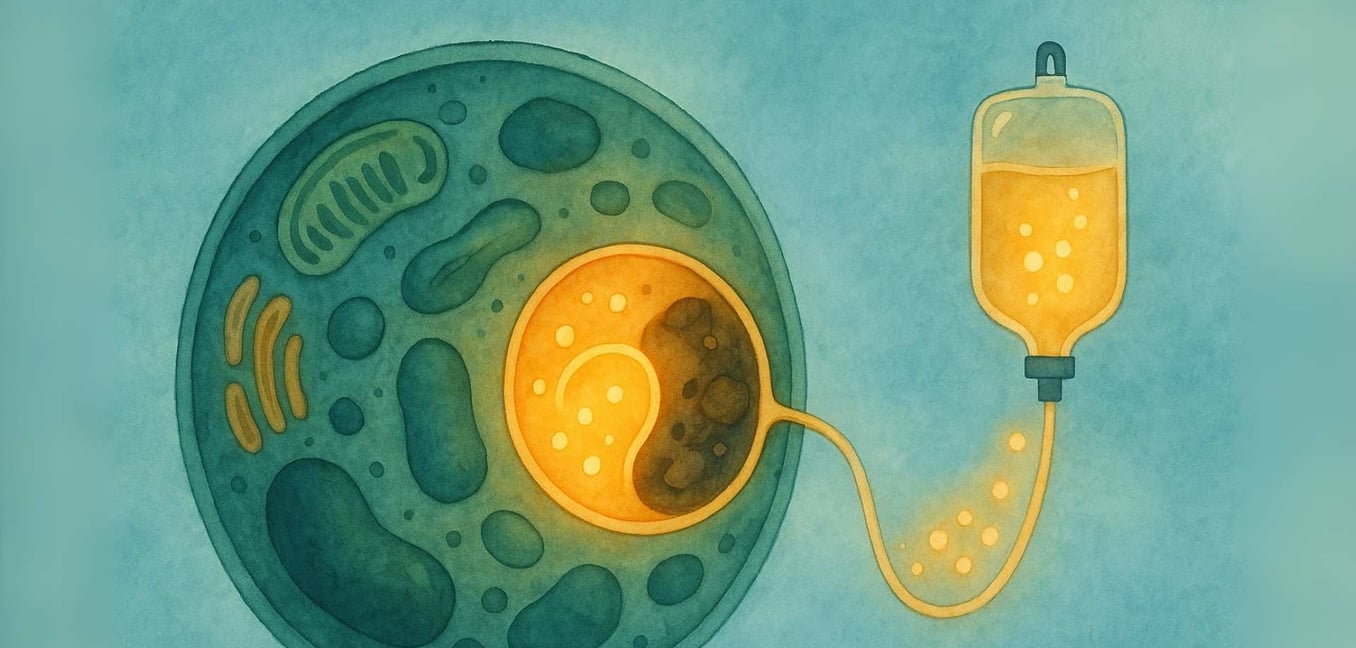
Die Reise mit einer seltenen Krankheit beginnt oft mit einer Suche nach Antworten. Für Einzelpersonen und Familien, die sich mit einer lysosomalen Speicherkrankheit (LSD) auseinandersetzen, führt diese Suche in die Mikrowelt unserer Zellen. Wir wissen, dass dies eine einschüchternde Landschaft sein kann, die mit komplexen wissenschaftlichen Begriffen und tiefgreifender Unsicherheit gefüllt ist. Unser Ziel ist es, diesen Weg mit Ihnen zu gehen, die Wissenschaft in klare, unterstützende Informationen aufzuteilen. Wir glauben an die Kraft des Verstehens und sind verpflichtet, einen Raum zu bieten, in dem Sie Klarheit, Gemeinschaft und die Gewissheit finden können, dass Sie auf dieser Reise nicht allein sind.
Was ist eine lysosomale Speicherkrankheit?
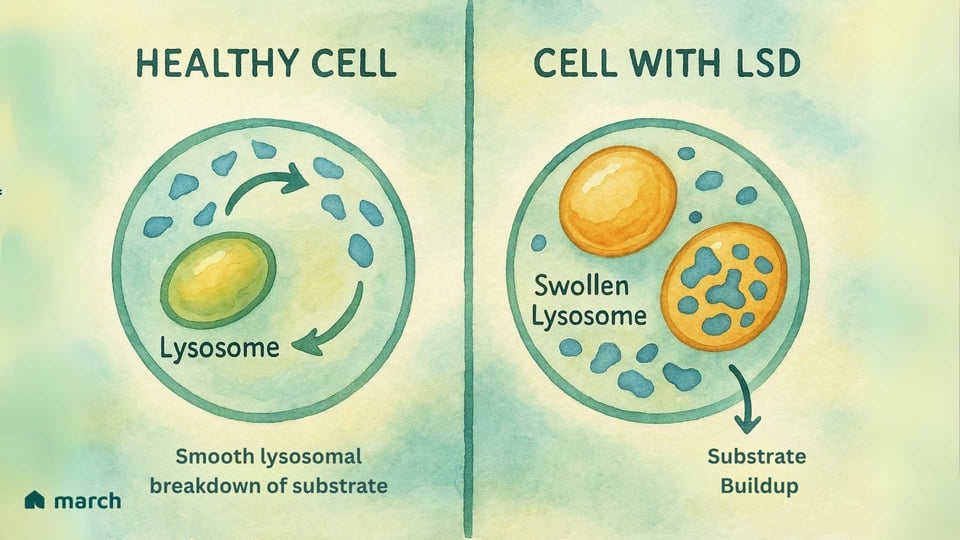
Im Kern ist eine lysosomale Speicherkrankheit (LSD) eine Herausforderung innerhalb des lebenswichtigen „Recyclingzentrums“ eines Organells, das Lysosom genannt wird. Die Geschichte der LSDs beginnt mit der bahnbrechenden Arbeit des belgischen Wissenschaftlers Christian de Duve, der in den 1950er Jahren das Lysosom entdeckte – eine Leistung, für die er 1974 den Nobelpreis erhielt. Er identifizierte diese winzigen Organellen als das Verdauungssystem der Zelle, gefüllt mit spezialisierten Proteinen, die Enzyme genannt werden. In einer gesunden Zelle sind die Lysosomen mit diesen Enzymen gefüllt, die komplexe Materialien wie Fette und Zucker in einfachere Bestandteile zerlegen, die die Zelle wiederverwenden kann (Platt, 2018).
Für jemanden mit einer LSD bedeutet eine spezifische Genmutation, dass eines dieser entscheidenden Enzyme entweder fehlt oder nicht richtig funktioniert. Die meisten LSDs sind autosomal rezessiv, was bedeutet, dass ein Kind eine Kopie des mutierten Gens von beiden Elternteilen erben muss, um die Erkrankung zu haben (Meikle et al., 1999).
Stellen Sie sich das Recycling-System einer Stadt vor, bei dem das Team, das für die Verarbeitung von Plastik verantwortlich ist, plötzlich aufhört zu arbeiten. Das Plastik würde sich stapeln und Probleme in der gesamten Stadt verursachen. Dies ist ähnlich dem, was in den Zellen einer LSD passiert. Das spezifische Material (genannt Substrat), das das fehlende Enzym verarbeiten sollte, beginnt sich anzusammeln (Platt, 2018). Im Laufe der Zeit führt dieser Aufbau dazu, dass die Lysosomen mit diesem gespeicherten Material überfüllt werden, was die Zellen schädigt. Diese "Zellabfallkrise" kann schließlich zu einem breiten Spektrum von Symptomen führen, die Organe im gesamten Körper betreffen (Parenti, Andria, & Ballabio, 2015).
Die diagnostische Odyssee: Ein vielfältiges Spektrum von Erkrankungen
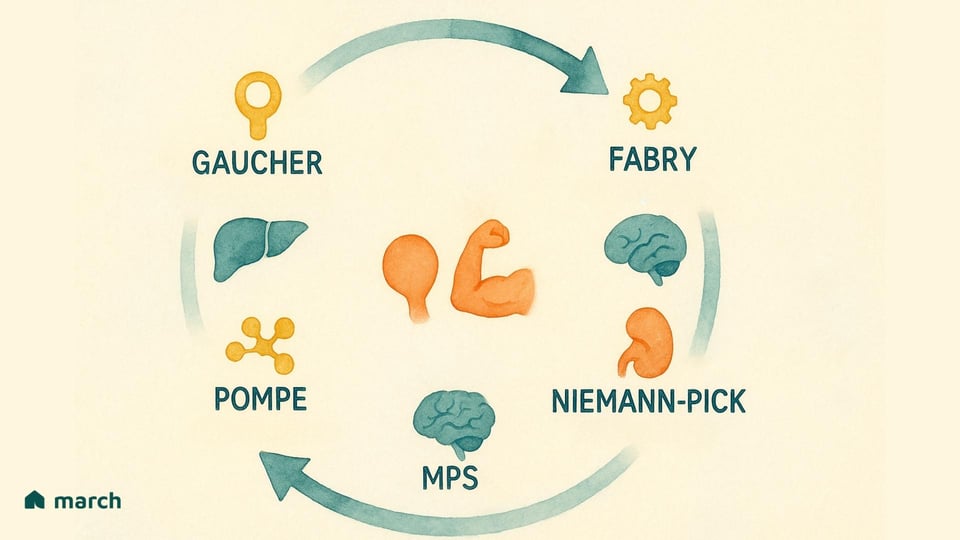
Forschende haben mittlerweile über 70 verschiedene Arten von LSDs identifiziert. Während alle von einem Problem innerhalb des Lysosoms ausgehen, manifestieren sie sich auf vielfältige Weise, jede definiert durch das spezifische Enzym, das fehlt, und das Substrat, das sich folglich ansammelt. Zu den bekannteren LSDs gehören:
Morbus Gaucher: Verursacht durch einen Mangel an dem Enzym Glukozerebrosidase, was zur Ansammlung eines fetthaltigen Stoffes namens Glukozerebrosid führt (Grabowski & Hopkin, 2022).
Pompe-Krankheit: Bezieht sich auf die Ansammlung eines komplexen Zuckers, Glykogen, der insbesondere Muskelzellen aufgrund eines Mangels des Enzyms saure α-Glucosidase beeinträchtigt (Kishnani et al., 2006).
Fabry-Krankheit: Resultiert aus einem Mangel an dem Enzym α-Galaktosidase A, was dazu führt, dass eine Art von Fett namens Globotriaosylceramid in Zellen im gesamten Körper ansteigt (Germain, 2010).
Mukopolysaccharidosen (MPS): Eine Gruppe verwandter Störungen (einschließlich Hurler-, Hunter- und Sanfilippo-Syndrom), bei denen verschiedene Enzyme fehlen, die erforderlich sind, um komplexe Zuckermoleküle namens Glykosaminoglykane (GAGs) abzubauen (Parenti, Andria, & Ballabio, 2015).
Niemann-Pick-Krankheit (Typen A, B, C) & Tay-Sachs-Krankheit: Weitere bekannte LSDs, die die Fähigkeit des Körpers beeinträchtigen, Fette (Lipide) zu metabolisieren, was zu schweren neurologischen Schäden führt (Platt, 2018).
Da Lysosomen in nahezu jeder Zelle vorhanden sind, sind die Symptome von LSDs außergewöhnlich vielfältig und fortschreitend. Sie können das Gehirn und das Nervensystem, das Herz, das Skelettsystem, die Leber, die Milz, die Lungen und sogar die Augen beeinträchtigen (Parenti, Andria, & Ballabio, 2015). Wir verstehen, dass jede Reise anders ist, und die Schwere und das Alter des Auftretens können dramatisch variieren, selbst bei Personen mit derselben benannten Erkrankung.
Den Weg zu einer Antwort navigieren
Für viele Familien ist der Weg zu einer Diagnose ein langer und mühsamer Prozess, ein Erlebnis, das oft als „diagnostische Odyssee“ bezeichnet wird (The LSD Collaborative, 2015). Frühzeitige Symptome können subtil, unspezifisch sein und häufigere Kinderkrankheiten imitieren, was zu frustrierenden Verzögerungen und Fehldiagnosen führt (Wraith, 2002). Wir wissen, wie schwierig diese Zeit der Ungewissheit sein kann, was die tiefgreifende Herausforderung des Bewusstseins unterstreicht, insbesondere bei denen, die nicht auf diese seltenen Erkrankungen spezialisiert sind. Eine Studie ergab, dass fast 89 % der befragten Hausärzte nie eine LSD als potenzielle Diagnose für einen ihrer Patienten in Betracht gezogen hatten, was die tiefgreifende Herausforderung des Bewusstseins verdeutlicht.
Die Erleichterung, endlich eine Diagnose zu erhalten – einen Namen für die perplexen und schmerzhaften Symptome zu haben – kann enorm sein. Wie eine Patientin, P., die an Fabry-Krankheit leidet, berichtete, begannen ihre Symptome in der Kindheit, aber sie wurde erst Jahrzehnte später diagnostiziert, nachdem in ihrer Familie bereits erhebliche Leiden aufgetreten waren.
Die diagnostischen Methoden sind zunehmend raffiniert geworden. Sie beinhalten typischerweise:
Enzym-Assays: Blutuntersuchungen, die das Aktivitätsniveau spezifischer lysosomaler Enzyme messen. Ein signifikant reduziertes oder fehlendes Niveau ist ein wichtiger Indikator für eine LSD (Sun, 2018).
Genetische Tests: Bestätigt die Diagnose, indem die spezifische Mutation im Gen identifiziert wird, die für das Enzym verantwortlich ist, was manchmal dabei helfen kann, die Schwere der Krankheit vorherzusagen oder Behandlungsentscheidungen zu leiten (Parenti, Andria, & Ballabio, 2015).
Neugeborenenscreening (NBS): In den letzten Jahren haben immer mehr Regionen behandelbare LSDs wie Pompe, Gaucher, Fabry und MPS I zu ihren Standardscreening-Panels für Neugeborene hinzugefügt (Burton, 2017). Durch die Identifizierung dieser Erkrankungen in den ersten Lebenstagen, bevor erhebliche und irreversible Schäden auftreten können, bietet das NBS die beste Gelegenheit, den Verlauf der Erkrankung zu ändern.
Die menschlichen Kosten: mehr als nur eine medizinische Akte
Wir wissen, dass die Auswirkungen einer LSD weit über die physischen Symptome hinausgehen. Dies sind chronische, fortschreitende und oft belastende Erkrankungen, die eine tiefgreifende medizinische, emotionale, soziale und finanzielle Last für Patienten und ihre Familien darstellen. Die täglichen Herausforderungen können das Management chronischer Schmerzen und lähmender Müdigkeit umfassen. Ted, ein Mann, der an Morbus Gaucher leidet, beschrieb eine lähmende Müdigkeit, die völlig anders war als gewöhnliche Ermüdung und selbst einfache Aufgaben monumental erscheinen ließ.
Die emotionale Landschaft ist komplex, gefüllt mit dem Stress, eine chronische Krankheit zu bewältigen, der Ungewissheit über die Zukunft und der Trauer, die mit nachlassender Gesundheit einhergehen kann. Wie Jennie, die Mutter von Sophia, die an Pompe-Krankheit leidet, teilte, war die Zeit nach der Diagnose erschreckend: "Der beängstigende Teil... war, keine definitiven Antworten zu haben und nicht zu wissen, was geschehen könnte oder wann." Es ist eine Reise, die die Dynamik der Familie und Lebensentscheidungen neu gestaltet, und wir sind verpflichtet, eine Gemeinschaft zu schaffen, in der diese tief persönlichen Erfahrungen geteilt, validiert und verstanden werden können.
Eine Idee wird Wirklichkeit
Über Jahrzehnte waren die Behandlungsmöglichkeiten für diese Erkrankungen herzzerreißend begrenzt. Aber eine revolutionäre Idee, die erstmals 1964 vom Entdecker des Lysosoms, Christian de Duve, konzipiert wurde, hat alles verändert (Beck, 2018). Das Konzept war einfach, aber tiefgreifend: Was wäre, wenn wir das fehlende Enzym von außen ersetzen könnten? Diese Einsicht legte den Grundstein für die Enzym-Ersatztherapie (ERT) (de Duve, 1964).
Der Weg von der Idee zur Klinik war ein Zeugnis immense wissenschaftlicher Hingabe. In den 1970er Jahren zeigten entscheidende Experimente, dass defiziente Zellen in einer Laborumgebung fehlende Enzyme, die von gesunden Zellen abgegeben wurden, aufnehmen konnten, ein Phänomen, das als „Kreuzkorrektur“ bekannt ist (Fratantoni, Hall, & Neufeld, 1968). Dies bewies, dass das grundlegende Prinzip funktionieren konnte. Weiterführende Forschungen identifizierten das zelluläre „Adressetikett“, das Enzyme zum Lysosom führt: ein Zuckermolekül namens Mannose-6-Phosphat (M6P), das an spezifische M6P-Rezeptoren an der Zelloberfläche bindet (Kornfeld, 1986).
Der wahre klinische Durchbruch wurde von Dr. Roscoe Brady und seinem Team am National Institutes of Health (Beck, 2018) vorangetrieben. Mit dem Fokus auf die Gaucher-Krankheit reinigten sie das benötigte Enzym (Glukozerebrosidase) aus menschlichen Plazentas und modifizierten es biochemisch, um die richtigen Zellen anzusprechen (Brady et al., 1974). Klinische Studien waren ein durchschlagender Erfolg, was zur ersten FDA-Zulassung für eine ERT, Ceredase™, im Jahr 1991 führte (Beck, 2018). Dies läutete eine neue Ära ein.
Heute werden ERTs dank rekombinanter DNA-Technologie nicht mehr aus menschlichem Gewebe gewonnen. Sie werden sicher und konsistent in großen Mengen in sicheren Laborumgebungen produziert, ein bedeutender Fortschritt, der die Sicherheit und Verfügbarkeit verbessert hat (Platt, 2018).
Wie funktioniert die Enzym-Ersatztherapie (ERT)?
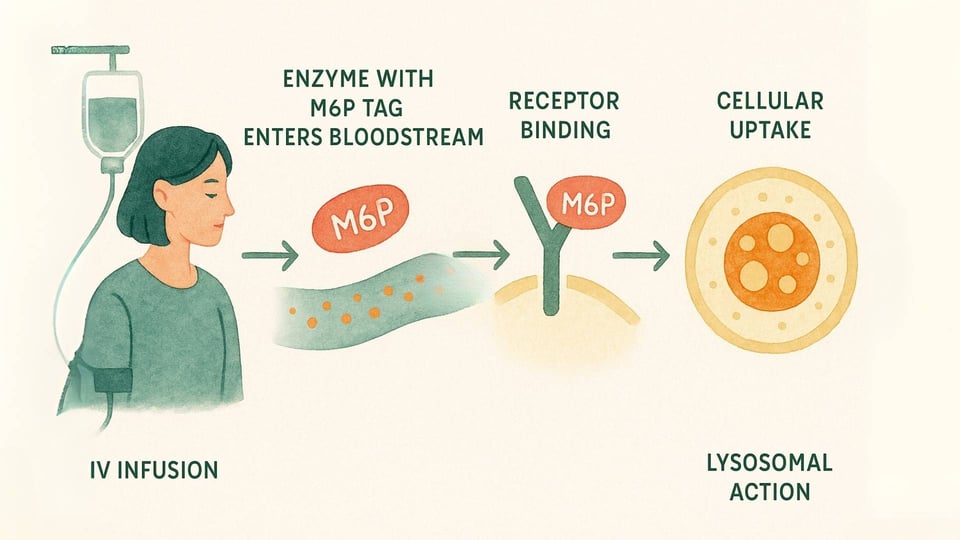
ERT ist eine medizinische Behandlung, die darauf abzielt, eine funktionsfähige Version des fehlenden Enzyms direkt zu den Zellen zu liefern, die es am dringendsten benötigen. Hier ist ein näherer Blick auf den Prozess:
Die Infusion: Die Therapie wird intravenös (IV) verabreicht, typischerweise in einer langsamen Infusion über mehrere Stunden, alle ein bis zwei Wochen (Beck, 2018).
Das Liefersystem: Diese Enzyme sind mit dem speziellen M6P „Adressetikett“ versehen, das die Zellen des Körpers erkennen können. Dies ermöglicht es dem Enzym, an die M6P-Rezeptoren an der Zelloberfläche zu binden, ähnlich einem Schlüssel, der in ein bestimmtes Schloss passt (Kornfeld, 1986).
Zelluläre Aktion: Sobald die Zelle das Enzym erkennt und daran bindet, wird es durch einen Prozess namens Endozytose aufgenommen und direkt zu den Lysosomen geleitet. Dort kann das Ersatzenzym endlich aktiv werden, die angesammelten Materialien abbauen und helfen, ein gesünderes Gleichgewicht innerhalb der Zelle wiederherzustellen (Kornfeld, 1986).
Die Behandlungsreise: Hoffnung und ehrliche Erwartungen
ERT ist eine Behandlung, kein Heilmittel (Platt, 2018). Es korrigiert nicht den zugrunde liegenden genetischen Defekt und erfordert ein lebenslanges Engagement für regelmäßige Infusionen, einen erheblichen Teil des Lebens für Patienten und ihre Familien (Beck, 2018).
Darüber hinaus steht ERT vor mehreren bedeutenden Hürden:
Die Blut-Hirn-Schranke (BBB): Dies ist arguably die größte Herausforderung. Die BBB ist ein schützender Schild, der große Moleküle, einschließlich ERT-Enzyme, daran hindert, ins Gehirn einzutreten. Da geschätzt zwei Drittel der LSDs neurologische Symptome aufweisen, kann die Standard-ERT häufig keine kognitiven Rückgänge oder andere zentrale neurologische Probleme adressieren, auch wenn sie dem Rest des Körpers hilft.
Die Immunantwort: Da das infundierte Enzym ein Protein ist, kann der Körper es manchmal als „fremd“ betrachten und Antikörper gegen das Medikament entwickeln (ADAs). Diese Antikörper können in einigen Fällen die Wirksamkeit der Therapie reduzieren oder infusionassoziierte Reaktionen (IARs) wie Fieber, Hautausschläge oder schwerwiegendere allergische Reaktionen verursachen.
Lieferung an „Zufluchtsorte“: Über das Gehirn hinaus sind bestimmte Gewebe für die großen Enzymmoleküle schwer zu erreichen. Dazu gehören dichte Knochen, avaskulärer Knorpel und Herzklappen, was bedeutet, dass skeletale Probleme und Klappenherzerkrankungen trotz Behandlung fortschreiten können.
Den Therapiewaffenarsenal erweitern
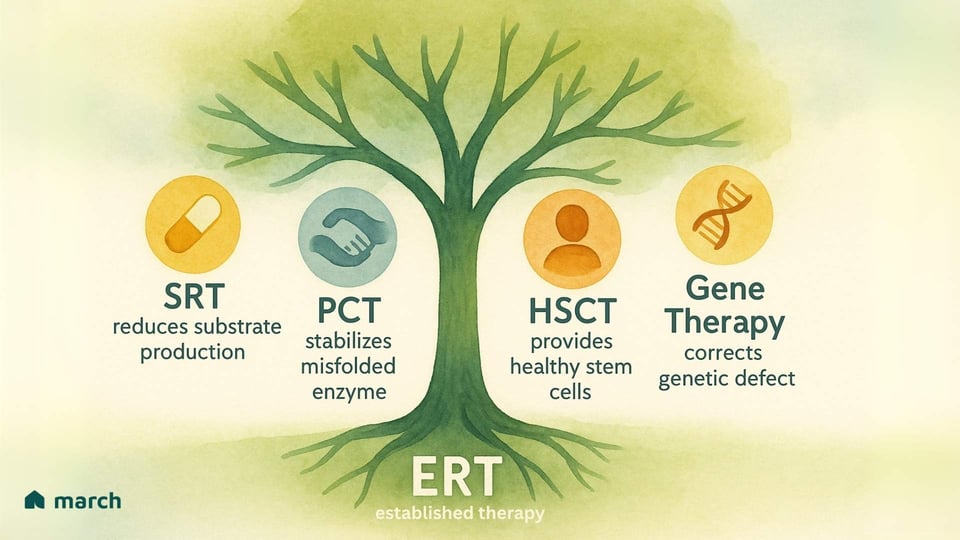
Die Einschränkungen der ERT haben Forscher und unsere Gemeinschaft inspiriert, unermüdlich für neue und bessere Therapien zu kämpfen. Die Zukunft der Behandlung konzentriert sich auf einen multiplen Angriff auf diese Erkrankungen, mit mehreren aufregenden Strategien, die sich abzeichnen:
Substratreduktionstherapie (SRT): Statt das Enzym zu ersetzen, wird bei diesem Ansatz ein orales Medikament verwendet, um ein Enzym zu hemmen, das in der Produktion des Substrats beteiligt ist. Dies „enthält die Last“ auf den beeinträchtigten Lysosomen. Genehmigte Medikamente wie Miglustat und Eliglustat werden bei Morbus Gaucher Typ 1 eingesetzt.
Pharmakologische Chaperontherapie (PCT): Für Patienten, deren Körper ein Enzym produziert, das fehlgefaltet, aber dennoch eine gewisse Funktion hat, wirken diese kleinen oralen Medikamente als „Gerüst“. Sie binden an das instabile Enzym und helfen, es korrekt zu falten, sodass es die Qualitätskontrolle der Zelle besteht und zum Lysosom gelangt, um seine Arbeit zu verrichten. Migalastat ist ein genehmigtes Chaperon für Fabry-Patienten mit spezifischen „annehmbaren“ Mutationen.
Hämatopoetische Stammzelltransplantation (HSCT): Bei einigen schweren LSDs mit ZNS-Beteiligung, wie MPS I (Hurler-Syndrom), kann HSCT (oder Knochenmarktransplantation) von einem gesunden Spender eine Option sein. Die Idee ist, dass die von Spender gewonnenen Zellen ins Gehirn wandern und eine lokale, kontinuierliche Quelle des fehlenden Enzyms bereitstellen. Allerdings handelt es sich um einen sehr risikobehafteten Eingriff mit erheblichen potenziellen Komplikationen.
Gentherapie: Dies ist eine der aufregendsten und potenziell transformativen Grenzen. Das Ziel ist es, eine funktionsfähige Kopie des richtigen Gens in die eigenen Zellen eines Patienten zu liefern, damit sie das Enzym selbst produzieren können. Mit Hilfe von gentechnisch veränderten viralen Vektoren oder anderen Liefersystemen erforschen Forscher Möglichkeiten, eine langanhaltende, potenziell einmalige Behandlung anzubieten, die die Wurzelursache der Krankheit korrigiert. Klinische Studien werden für Pompe, Fabry und mehrere MPS-Erkrankungen durchgeführt, was eine kraftvolle Quelle der Hoffnung bietet.
Gemeinsam voranschreiten
Der Weg von der grundlegenden Entdeckung des Lysosoms bis zur Entwicklung von ERT und dem Aufbruch der genbasierten Medizin ist ein Zeugnis für die Kraft wissenschaftlicher Forschung und menschlicher Resilienz. Wir sind verpflichtet, diesen Fortschritt gemeinsam fortzusetzen. Wir werden immer bestrebt sein, vertrauenswürdige, klare Informationen bereitzustellen, eine unterstützende und fürsorgliche Gemeinschaft zu fördern und die Forschung zu unterstützen, die greifbare Hoffnung auf eine bessere Zukunft bringt.
Für eine prägnante und dennoch aufschlussreiche Übersicht über die Enzym-Ersatztherapie laden wir Sie ein, in unsere neue Podcast-Episode reinzuhören. Sie wurde entwickelt, um dieses komplexe Thema in leicht verdauliche Segmente zu unterteilen.
<iframe width="560" height="315" src="https://www.youtube.com/embed/T91yim2x8ac?si=5aRF203Rw9fqjAoN" title="YouTube video player" frameborder="0" allow="accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture; web-share" referrerpolicy="strict-origin-when-cross-origin" allowfullscreen></iframe>
Literaturverzeichnis
Nobel Prize Outreach AB. (2024). Der Nobelpreis für Physiologie oder Medizin 1974. NobelPrize.org.
de Duve, C. (2013). Christian de Duve: Entdecker der Zelle, der neue Organellen mithilfe einer Zentrifuge entdeckte. Proceedings of the National Academy of Sciences, 110(31), 12559-12561.
Die Rockefeller University. (o. D.). "Zellen mit einer Zentrifuge erkunden": Die Entdeckung des Lysosoms. Hospital Centennial.
MSD Manual Professional Edition. (o. D.). Übersicht über lysosomale Speichererkrankungen.
Columbia University Irving Medical Center. (o. D.). Pädiatrische lysosomale Speichererkrankungen.
Cleveland Clinic. (2022, 27. Juni). Lysosomale Speicherkrankheiten & -Störungen.
Cleveland Clinic. (2022, 27. Juni). Lysosomale Speicherkrankheiten & -Störungen.
Bioscience Institute. (o. D.). Lysosomale Speicherkrankheiten (LSDS).
van der Meijden, J. C., et al. (2010). „Doktor Google“ beendet die diagnostische Odyssee bei lysosomalen Speicherkrankheiten. Archives of Disease in Childhood, 95(8), 642-644.
Medicover Genetics. (2025, 26. Februar). Die diagnostische Odyssee: Die Suche nach Antworten bei seltenen Krankheiten.
Rare Diseases South Africa. (2023, 28. Februar). Die Herausforderungen bei der Diagnose und Behandlung lysosomaler Speicherkrankheiten angehen.
Greenwood Genetic Center. (2024, 14. August). Lysosomale Speicherkrankheiten: Morbus Gaucher und Fabry-Krankheit.
Wikipedia. (o. D.). Enzym-Ersatztherapie.
Beck, M. (2018). Enzym-Ersatztherapie und darüber hinaus - in memoriam Roscoe O. Brady, M.D. (1923–2016). Journal of Inherited Metabolic Disease, 41(1), 3-13.
Park, J. J., & Lee, K. (2022). Mannose-6-Phosphat-Glykane zur lysosomalen Zielgerichtetheit: verschiedene Anwendungen von der Enzym-Ersatztherapie bis zu lysosomalen Zielstruktur-Chimären. Animal Cells and Systems, 26(3), 84-91.
U.S. Food & Drug Administration (FDA). (1991). Suche nach Waisendrogen-Bezeichnungen und -Genehmigungen: Ceredase.
National Gaucher Foundation. (o. D.). Der 25. Jahrestag der FDA-Zulassung von ERT.
Begley, D. J. (2015). Modifizierung des Transports über die Blut-Hirn-Schranke, um Hoffnung für Patienten mit lysosomalen Speicherkrankheiten zu bringen. Journal of Cerebral Blood Flow & Metabolism, 35(1), 3-5.
Pardridge, W. M. (2015). Zielgerichtete Therapie lysosomaler therapeutischer Enzyme über die Blut-Hirn-Schranke. Lysosomale Speichererkrankungen, 327-343.
Aflaki, E., et al. (2018). Enzym-Ersatztherapien: Was ist die beste Option?. Current Pharmaceutical Design, 24(11), 1238-1250.
Giugliani, R., et al. (2018). Enzym-Ersatztherapie bei Mukopolysaccharidosen: neue Entwicklungen und klinische Ergebnisse. Expert Opinion on Orphan Drugs, 6(4), 277-287.
Gaucher Disease News. (o. D.). Substratreduktionstherapie für Morbus Gaucher.
National Gaucher Foundation. (o. D.). Substratreduktionstherapie.
Shin, S-H., et al. (2007). Die pharmakologische Chaperontherapie korrigiert die lysosomale Speicherung bei Fabry-Krankheit aufgrund von Transportstörungen. American Journal of Physiology-Cell Physiology, 292(5), C1879-C1887.
Fabry Disease News. (2024, 19. April). Chaperontherapie für Fabry-Krankheit.
National MPS Society. (o. D.). HSCT.
La-Fauci, G., & A.H. Schuchman. (2016). Gentherapie bei lysosomalen Speicherkrankheiten: Jüngste Fortschritte und Einschränkungen. Journal of Inborn Errors of Metabolism and Screening, 4, 1-7.
Iimori, T., et al. (2023). Gentherapie für lysosomale Speicherkrankheiten: Aktuelle klinische Studienperspektiven. Frontiers in Genetics, 14, 1064924.
Platt, F. M., d'Azzo, A., Davidson, B. L., Neufeld, E. F., & Tifft, C. J. (2018). Lysosomale Speicherkrankheiten. Nature Reviews Disease Primers, 4(1), 27.