Para muchas familias en nuestra comunidad, el viaje con una enfermedad genética rara comienza con un solo y diminuto error en el manual de instrucciones del cuerpo: nuestro ADN. Sabemos que entender la ciencia detrás de estas condiciones puede ser uno de los primeros pasos hacia empoderarse. Durante décadas, los tratamientos se han centrado en manejar los síntomas en lugar de abordar la fuente del problema. Pero hoy, queremos acompañarte a través de un desarrollo que representa un nuevo capítulo de esperanza, una historia de increíble progreso científico que llega al corazón de estas condiciones.
Estamos escuchando más sobre una tecnología innovadora llamada edición de bases in vivo. Sabemos que estos términos científicos pueden resultar intimidantes, así que nuestro objetivo aquí es desglosarlo juntos. Esta es una historia sobre pasar de hacer grandes cambios en nuestro ADN a hacer cambios increíblemente precisos. Se trata de un nuevo tipo de "lápiz molecular" que ofrece un enfoque más suave y específico para corregir el error genético original.[1]
Esta es una inmersión profunda en la ciencia, la esperanza y los desafíos realistas de esta nueva frontera. Creemos que, al comprenderlo, podemos tener conversaciones más informadas, hacer mejores preguntas y avanzar juntos con una comprensión más clara de lo que el futuro puede deparar.
De Tijeras Moleculares a un Lápiz Genético: La Evolución de la Edición Genética
Para entender el avance de la edición de bases, primero es útil mirar la tecnología que vino antes: CRISPR-Cas9. Puede que hayas oído describir a CRISPR como "tijeras moleculares." [1] Fue un descubrimiento revolucionario que dio a los científicos la capacidad de encontrar un lugar específico en nuestro ADN y hacer un corte. Este fue un salto monumental hacia adelante, permitiendo a los investigadores "apagar" genes defectuosos. Esta tecnología es la base para la primera terapia aprobada basada en CRISPR para la enfermedad de células falciformes, Casgevy, donde las células se extraen del cuerpo, se editan con estas tijeras y luego se devuelven al paciente.
Si bien es increíblemente poderosa, la idea de hacer un corte de doble hebra en nuestro ADN siempre ha tenido desafíos. El proceso de reparación natural de la célula para tal corte puede ser un poco impredecible, a veces llevando a cambios no deseados.[2] Sabemos que para que cualquier terapia se use ampliamente, especialmente dentro del cuerpo, la seguridad es la máxima prioridad.
Aquí es donde entra la edición de bases, representando el siguiente paso en este viaje de progreso. Desarrollada por investigadores, incluido un equipo dirigido por el Dr. David Liu en la Universidad de Harvard y el Broad Institute, la edición de bases fue diseñada para ser más como un "lápiz molecular".[3][4] Se creó para hacer un cambio preciso a una sola letra del código del ADN sin hacer un corte disruptivo.[5][6]
Así es como podemos pensar en su funcionamiento:
La Guía: Una molécula llamada ARN guía (gRNA) actúa como un GPS, llevando al editor de bases al "error tipográfico" exacto y específico en los miles de millones de letras que componen nuestro ADN.[1]
El Ancla: El editor de bases utiliza una proteína CRISPR desactivada (a menudo llamada nickase o Cas9 "muerto") como ancla. Se aferra al ADN en el lugar correcto, pero—y esta es la clave—no hace un corte de doble hebra.[5][7]
El Lápiz: Fusionado a este ancla hay una enzima especial (una deaminasa) que actúa como el lápiz. Realiza una reacción química que efectivamente borra la letra de ADN incorrecta y la reemplaza con la correcta.[7][8]
La belleza de este enfoque es su precisión y su naturaleza suave. Al evitar un corte, elude muchas de las preocupaciones asociadas con las "tijeras moleculares" originales, ofreciendo una forma potencialmente más segura de corregir los errores genéticos fundamentales que causan tantas enfermedades raras.[1][9]
El Desafío de la Entrega: Llevar el Lápiz a la Página Correcta
Tener un "lápiz genético" increíble es una cosa, pero llevarlo a las células adecuadas en lo profundo del cuerpo es uno de los mayores desafíos en toda la terapia génica.[2][10] Esta es la parte "in vivo" del rompecabezas: hacer las ediciones dentro del cuerpo vivo. Para muchas condiciones que afectan órganos como el hígado, el cerebro o los músculos, esta es la única manera en que una terapia genética puede funcionar.
Los científicos están trabajando incansablemente en este problema de entrega, y han surgido dos enfoques principales como los principales contendientes. Piénsalo como dos tipos diferentes de camiones de entrega microscópicos:
Vectores Virales (como AAVs): Estos son esencialmente las conchas de virus que han sido vaciadas y reingenierizadas para que no puedan causar enfermedad. En cambio, están llenas de las instrucciones genéticas para hacer el editor de bases.
El Lado Positivo: Los virus son naturalmente muy buenos para ingresar a nuestras células, y diferentes tipos de Virus Asociados a Adenovirus (AAVs) son conocidos por dirigirse a tejidos específicos como los músculos o los ojos.[11] Tienen un largo historial en la investigación de terapia génica.
Los Desafíos: Sabemos que nuestros cuerpos están diseñados para combatir virus. Esto significa que muchas personas tienen inmunidad preexistente que podría detener el vector antes de que cumpla su trabajo.[12][13] Esta respuesta inmune también hace difícil administrar una segunda dosis.[12] Además, los AAVs tienen un espacio de "carga limitada" de aproximadamente 4.7 kilobases, lo que puede ser un apretón para la maquinaria de edición de bases.[14][15]
Nanopartículas Lipídicas (LNPs): Es posible que hayas oído hablar de estas a partir de las vacunas de ARNm contra el COVID-19. Las LNPs son pequeñas burbujas de grasa, diseñadas, que pueden llevar las instrucciones genéticas (en forma de ARNm) para el editor de bases.[16][17]
El Lado Positivo: Las LNPs tienen un espacio de carga más grande y son menos propensas a desencadenar una respuesta inmune fuerte, lo que significa que podría ser posible volver a dosificar.[2][16] Una gran ventaja de seguridad es que entregan instrucciones temporales. La célula produce el "lápiz", realiza su trabajo y luego las instrucciones y el lápiz se eliminan naturalmente. Esta ventana corta de actividad reduce el riesgo de cualquier edición no deseada.[18]
Los Desafíos: En este momento, cuando se administran a través de una IV, la mayoría de las LNPs son naturalmente absorbidas por el hígado.[19][20] Si bien esto es perfecto para tratar enfermedades del hígado, los investigadores están trabajando arduamente para diseñar nuevas LNPs que puedan ser dirigidas a otros tejidos en todo el cuerpo.[16]
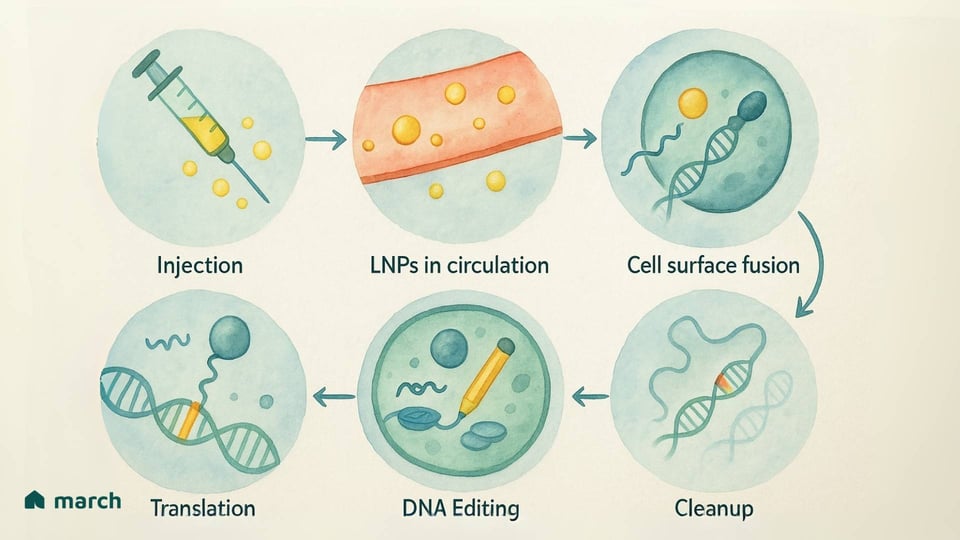
El progreso en estos sistemas de entrega es tan importante como las herramientas de edición en sí mismas. Cada paso adelante en hacer que estos "camiones" sean más seguros y específicos es un paso adelante para nuestra comunidad.
Un Momento Histórico: El Primer Humano en Recibir Edición de Bases In Vivo
Durante años, esta tecnología fue objeto de investigaciones esperanzadoras en laboratorios. Pero recientemente, presenciamos un momento histórico que lo trasladó de la teoría a la realidad. La historia de K.J. Muldoon, un bebé nacido con una enfermedad genética rara severa y potencialmente mortal, ha sido una fuente de increíble inspiración.
K.J. fue diagnosticado con deficiencia de carbamoyl-fosfato sintasa 1 (CPS1), un trastorno metabólico raro donde el hígado no puede procesar el amoníaco, un subproducto tóxico de la descomposición de proteínas.[21][22] Esta condición puede ser devastadora, con una tasa de mortalidad estimada del 50% en los primeros meses de vida.[23] Sabemos el temor y la incertidumbre que vienen con un diagnóstico como este.
Pero la condición específica de K.J. fue causada por un error tipográfico de una sola letra en su ADN, un candidato perfecto para la edición de bases. En un esfuerzo notable, se diseñó una terapia personalizada solo para él en solo seis meses.[21] Recibió una infusión intravenosa de una LNP: la pequeña burbuja de grasa que transportaba las instrucciones de ARNm para un "lápiz" editor de bases diseñado para corregir su mutación exacta.[24][25]
Los primeros resultados han sido una fuente de profunda esperanza:[23]
K.J. comenzó a tolerar más proteínas en su dieta.
La dosis de medicamentos que necesitaba para controlar sus niveles de amoníaco se redujo significativamente.
Comenzó a alcanzar sus hitos de desarrollo.
Lo más poderoso es que pudo combatir dos virus infantiles comunes sin entrar en una crisis potencialmente mortal, algo que habría sido casi seguro antes de la terapia.
Debemos caminar por este camino con tanto esperanza como realismo. Esta fue una terapia para un niño valiente, y aún necesitamos ver cuánto tiempo durará la corrección.[23] Pero esta única historia es una prueba de concepto poderosa. Demuestra que esta tecnología es posible y tiene el potencial de cambiar vidas. También abre la puerta a un futuro donde las terapias podrían adaptarse a la composición genética única de un individuo.[24]
Esta no es solo una historia. La investigación está en marcha para otras condiciones. En modelos de laboratorio de progeria, una enfermedad de envejecimiento prematuro, la edición de bases ha corregido el error genético y ha extendido dramáticamente la esperanza de vida de los ratones. También se están llevando a cabo ensayos clínicos utilizando la edición de bases para condiciones como el colesterol alto (dirigido por Verve Therapeutics) y la deficiencia de alfa-1 antitripsina (dirigido por Beam Therapeutics).[26][27] Esta ola de investigación es impulsada por las necesidades de muchas comunidades de pacientes diferentes, y cada éxito genera impulso para el siguiente.
Avanzando Juntos: El Viaje por Delante
El amanecer de la edición de bases in vivo es increíblemente emocionante, pero como comunidad, sabemos que el progreso debe hacerse de manera responsable y con transparencia. Aún hay desafíos significativos que superar, y es importante que hablemos de ellos abiertamente.
La Seguridad Siempre Primero: La máxima prioridad es asegurarse de que el "lápiz" solo edite la letra de ADN deseada y nada más. Los científicos han desarrollado métodos rigurosos para verificar estas ediciones "fuera de objetivo" y están trabajando constantemente para hacer que las herramientas sean aún más precisas.[9][28]
Entendiendo los Efectos a Largo Plazo: Para cualquier terapia que realice un cambio permanente, necesitamos seguir a los pacientes durante mucho tiempo para garantizar que los beneficios sean duraderos y que no surjan problemas inesperados en el futuro.[10][29]
El Desafío del Acceso: Sabemos que estas terapias avanzadas son actualmente increíblemente complejas y costosas de elaborar, con algunas terapias génicas que superan los 2 millones de dólares por tratamiento.[30][31][32] Como comunidad, es vital que aboguemos por un futuro donde estos tratamientos que cambian la vida sean accesibles para todos los que los necesitan, independientemente de dónde vivan o qué recursos tengan.[33] Esta es una conversación que debemos tener ahora, al principio.
El campo no se está deteniendo. Los científicos ya están desarrollando la próxima generación de herramientas, como la edición primaria, otra innovación del laboratorio del Dr. Liu que funciona como una función de "buscar y reemplazar" para el ADN y puede corregir aún más tipos de errores genéticos, incluidas pequeñas inserciones y deleciones.[34][35][36][37][38][39]
Mientras observamos cómo se desarrolla esta nueva frontera de la medicina, estamos comprometidos a proporcionarte información clara y confiable. Celebraremos los avances y seremos honestos sobre los desafíos. Continuaremos construyendo una comunidad donde podamos aprender, compartir y apoyarnos mutuamente. Tus ideas, tus experiencias y tu esperanza son lo que alimenta este avance. En este viaje de descubrimiento, no estás solo.
Para un resumen rápido, escucha nuestro nuevo episodio de podcast, explorando la historia y la ciencia de esta terapia.
https://youtu.be/-aVHZciahbw
Fuentes
[7] Menichiello, T. (2023, 27 de septiembre). Edición de bases y edición primaria: cómo están cambiando la terapia génica. Cell & Gene.
[30] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024). El precio asequible de los tratamientos CRISPR es un imperativo ético urgente. CRISPR Journal.
[1] BioTechniques. (2017, 1 de noviembre). Lápices moleculares reescriben bases.
[40] Verve Therapeutics. (2025). VERVE-102. Recuperado de vervetx.com.
[31] Glick, B. (2023, 8 de diciembre). Nuevas terapias génicas costosas para la enfermedad de células falciformes plantean un desafío de acceso. BioPharma Dive.
[33] CRISPR Therapeutics Canada. (2025, 28 de enero). El costo real del tratamiento CRISPR: lo que los pacientes canadienses necesitan saber.
[8] Genethique. (2017, 2 de noviembre). ABE (editor de bases de adenina): un "editor de bases" para completar el kit de herramientas CRISPR.
[21] Technology Networks. (2025, 27 de junio). Cómo se creó la primera terapia genética personalizada en 6 meses.
[2] Open Access Journals. (s.f.). Problemas enfrentados por los médicos en terapia génica. Journal of Gene Therapy.
[41] Rare Disease Advisor. (2025, 15 de abril). Verve Therapeutics informa sobre resultados prometedores para la edición génica PCSK9 en HeFH.
[12] Biocompare. (2025, 2 de enero). Superando desafíos en terapias génicas basadas en AAV y rAAV.
[32] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024, 14 de octubre). El precio asequible de los tratamientos CRISPR es un imperativo ético urgente. ResearchGate.
[10] Consensus. (s.f.). ¿Cuáles son los desafíos del desarrollo de terapias génicas para trastornos genéticos?
[14] Form Bio. (s.f.). El papel del AAV en la terapia génica.
[22] Sanders, R. (2025, 15 de mayo). Un bebé nacido con una enfermedad mortal ahora prospera gracias a un tratamiento CRISPR personalizado seis meses después del nacimiento. Berkeley News.
[5] Ma, Y., et al. (2023). Edición del genoma precisa con editores de bases. Journal of Genetics and Genomics.
[34] Howard Hughes Medical Institute. (2020, 12 de junio). La edición del genoma de precisión entra en la era moderna.
[9] MedNexus. (2024). Terapia génica dirigida: promesas y desafíos en el manejo de enfermedades. Journal of Bio-X Research.
[15] BioInnovatise. (2024, 9 de diciembre). Recursos de capacidad de empaquetado de AAV.
[24] Ahn, N. (2025, 22 de mayo). Investigadores de Penn Med y CHOP tratan a un bebé con la primera terapia de edición genética personalizada del mundo. The Daily Pennsylvanian.
[28] Frontiers in Pediatrics. (2024). Avances y desafíos en las estrategias de terapia génica para el cáncer pediátrico: una actualización completa.
[35] Rett Syndrome Research Trust. (s.f.). Edición primaria.
[29] Patsnap. (2025, 20 de marzo). ¿Cuáles son los desafíos éticos en la terapia génica?
[26] Taylor, N.P. (2025, 5 de mayo). 'Más segura' CRISPR: la edición de bases avanza en la clínica a medida que Beam y Verve avanzan. BioSpace.
[36] Cross, R. (2019, 2 de diciembre). Presentando CRISPR 3.0. C&EN Global Enterprise.
[23] Garcia de Jesus, E. (2025, 28 de mayo). La edición genética personalizada salvó a un bebé, pero el futuro de la tecnología es incierto. Science News.
[37] Synthego. (s.f.). La edición primaria como herramienta de edición genética de precisión.
[6] SCMP. (2023, 31 de mayo). Científicos chinos desarrollan una nueva herramienta de edición genética que difiere en el enfoque de CRISPR-Cas9.
[27] DeFeudis, N. (2025, 11 de marzo). Beam comparte datos clínicos prometedores sobre el tratamiento de edición genética para una enfermedad pulmonar e hepática. Endpoints News.
[42] Wu, G. (2025, 24 de marzo). Verve obtiene luz verde de la FDA para expandir el ensayo de edición de bases en EE. UU. BioPharma Dive.
[3] Broad Institute. (2025, 5 de abril). David Liu recibe el Premio Breakthrough en Ciencias de la Vida.
[4] Howard Hughes Medical Institute. (2025, 5 de abril). David Liu recibe el Premio Breakthrough.
[43] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024). El precio asequible de los tratamientos CRISPR es un imperativo ético urgente. Digital CSIC.
[13] High, K. A., & Roncarolo, M. G. (2019). Respuestas inmunes a los vectores AAV: superando barreras para una terapia génica exitosa. Molecular Therapy.
[38] O'Hanlon Cohrt, K. (2023, 4 de diciembre). Explicador: ¿Qué es la edición primaria y para qué se utiliza?. CRISPR Medicine News.
[44] O'Hanlon Cohrt, K. (2025, 14 de mayo). Las últimas actualizaciones de ensayos clínicos de CRISPR Medicine News.
[16] GenScript. (2024, 15 de octubre). Nanopartículas lipídicas: un avance en los sistemas de entrega de CRISPR.
[39] Davies, H., & Auguste, A. (2023). Edición del genoma en base y prime en oncología de precisión. Cancer Research.
[11] Revvity. (s.f.). Vectores AAV: desafíos y soluciones para la fabricación de terapia génica.
[45] Verve Therapeutics. (2025, 14 de mayo). Verve Therapeutics anuncia progreso en su cartera y reporta resultados financieros del primer trimestre de 2025.
[46] CRISPR Medicine News. (2025, 11 de marzo). Beam Therapeutics informa datos clínicos de prueba de concepto para BEAM-302 en el ensayo de deficiencia de alfa-1 antitripsina.
[47] Verve Therapeutics. (2025, 11 de abril). Verve Therapeutics recibe designación de vía rápida de la FDA para VERVE-102, un medicamento de edición de bases in vivo dirigido a PCSK9.
[48] Beam Therapeutics. (2025, 10 de marzo). Beam Therapeutics anuncia datos iniciales positivos para BEAM-302 en el ensayo de fase 1/2 en deficiencia de alfa-1 antitripsina (AATD), demostrando la primera corrección genética clínica de una mutación que causa enfermedad.
[25] Children's Hospital of Philadelphia. (2025, 15 de mayo). Primer paciente tratado con terapia de edición genética CRISPR personalizada en el Children's Hospital of Philadelphia.
[17] ACS Publications. (2022, 20 de mayo). Entrega de componentes de edición del genoma CRISPR/Cas9 basada en nanopartículas lipídicas.
[18] PubMed Central (PMC). (s.f.). Nanopartículas lipídicas: el cambio de juego en la edición del genoma CRISPR-Cas9.
[49] Promega Connections. (2025, 28 de mayo). Brillantez en la edición de bases: el Premio Breakthrough de David Liu y su impacto.
[19] Nano Magazine. (2022, 19 de diciembre). Entrega mediada por nanopartículas lipídicas de componentes de CRISPR para la edición del genoma neuronal.
[20] ACS Nanoscience Au. (2023, 30 de marzo). Avances recientes en nanopartículas lipídicas específicas para la entrega de ARNm.









