Pour de nombreuses familles de notre communauté, l'aventure avec une maladie génétique rare commence par une seule petite erreur dans le manuel d'instruction du corps—notre ADN. Nous savons qu'une compréhension de la science derrière ces conditions peut être l'une des premières étapes pour se sentir habilité. Pendant des décennies, les traitements se sont concentrés sur la gestion des symptômes plutôt que sur l'adresse de la source du problème. Mais aujourd'hui, nous voulons vous accompagner à travers un développement qui représente un nouveau chapitre d'espoir, une histoire de progrès scientifique incroyable qui touche au cœur même de ces conditions.
Nous entendons de plus en plus parler d'une technologie révolutionnaire appelée édition de base in vivo. Nous savons que ces termes scientifiques peuvent sembler intimidants, donc notre objectif ici est de les expliquer ensemble. C'est une histoire sur le passage des grands changements dans notre ADN à des changements incroyablement précis. Il s'agit d'un nouveau type de "crayon moléculaire" qui offre une approche plus douce et plus ciblée pour corriger la typographie génétique d'origine.[1]
Ceci est une plongée approfondie dans la science, l'espoir et les défis réalistes de cette nouvelle frontière. Nous croyons qu'en le comprenant, nous pouvons avoir des conversations plus éclairées, poser de meilleures questions et avancer ensemble avec une vision plus claire de ce que l'avenir pourrait nous réserver.
Des ciseaux moléculaires à un crayon génétique : L'évolution de l'édition génique
Pour comprendre la percée de l'édition de base, il aiderait de d'abord examiner la technologie qui l'a précédée : CRISPR-Cas9. Vous avez peut-être entendu parler de CRISPR décrit comme des "ciseaux moléculaires.”[1] C'était une découverte révolutionnaire qui a donné aux scientifiques la possibilité de trouver un endroit spécifique dans notre ADN et de faire une coupure. C'était un saut monumental en avant, permettant aux chercheurs de "désactiver" des gènes défectueux. Cette technologie est la base de la première thérapie basée sur CRISPR jamais approuvée pour la maladie de la cellule falciforme, Casgevy, où les cellules sont extraites du corps, modifiées avec ces ciseaux, puis retournées au patient.
Bien que puissants, l'idée de faire une coupure double-brin dans notre ADN a toujours été accompagnée de défis. Le processus de réparation naturel de la cellule pour une telle coupe peut être un peu imprévisible, conduisant parfois à des changements inattendus.[2] Nous savons que pour qu'une thérapie puisse être largement utilisée, surtout dans le corps, la sécurité est la priorité absolue.
C'est ici que l'édition de base entre en jeu, représentant la prochaine étape de ce parcours de progrès. Développée par des chercheurs, y compris une équipe dirigée par Dr. David Liu à l'Université de Harvard et au Broad Institute, l'édition de base a été conçue pour être plus comme un "crayon moléculaire." [3][4] Elle a été créée pour effectuer un changement précis à une seule lettre du code ADN sans faire de coupure disruptive.[5][6]
Voici comment nous pouvons envisager son fonctionnement :
Le Guide : Une molécule appelée ARN guide (gRNA) agit comme un GPS, guidant l'éditeur de base vers la "typo" exacte et spécifique dans les milliards de lettres qui composent notre ADN.[1]
L'Ancre : L'éditeur de base utilise une protéine CRISPR désactivée (souvent appelée nickase ou "dead" Cas9) comme ancre. Il se fixe à l'ADN au bon endroit, mais—et c'est la principale différence—il ne fait pas de coupure double-brin.[5][7]
Le Crayon : Fusionné à cette ancre se trouve une enzyme spéciale (une désaminase) qui agit comme le crayon. Elle effectue une réaction chimique qui efface efficacement la lettre ADN incorrecte et la remplace par la bonne.[7][8]
La beauté de cette approche est sa précision et sa douceur. En évitant une coupure, elle contourne de nombreuses préoccupations associées aux "ciseaux moléculaires" d'origine, offrant un moyen potentiellement plus sûr de corriger les erreurs génétiques fondamentales qui causent tant de maladies rares.[1][9]
Le Défi de la Livraison : Remettre le Crayon à la Bonne Page
Avoir un "crayon génétique" incroyable est une chose, mais le ramener aux bonnes cellules profondément dans le corps est l'un des plus grands défis de toute la thérapie génique.[2][10] C'est la partie "in vivo" du puzzle—effectuer les modifications dans le corps vivant. Pour les nombreuses conditions qui affectent des organes comme le foie, le cerveau ou les muscles, c'est le seul moyen par lequel une thérapie génétique peut fonctionner.
Les scientifiques travaillent sans relâche sur ce problème de livraison, et deux approches principales ont émergé comme les favorites. Pensez à elles comme à deux types différents de camions de livraison microscopiques :
Vecteurs Viraux (comme les AAV) : Ce sont essentiellement les coques de virus qui ont été vidées et ré-ingénierées pour qu'elles ne puissent pas provoquer de maladies. Au lieu de cela, elles sont remplies des instructions génétiques pour fabriquer l'éditeur de base.
Le Bon Côté : Les virus sont naturellement très bons pour entrer dans nos cellules, et différents types de Virus Associés aux Adénos (AAV) sont connus pour cibler des tissus spécifiques comme les muscles ou les yeux.[11] Ils ont un long historique dans la recherche sur la thérapie génique.
Les Défis : Nous savons que nos corps sont conçus pour combattre les virus. Cela signifie que de nombreuses personnes ont une immunité préexistante qui pourrait arrêter le vecteur avant qu'il ne fasse son travail.[12][13] Cette réponse immunitaire rend également difficile la délivrance d'une seconde dose.[12] De plus, les AAV ont un "espace de chargement" limité d'environ 4,7 kilobases, ce qui peut être un peu juste pour la machinerie d'édition de base.[14][15]
Nanoparticules Lipidiques (LNP) : Vous en avez peut-être entendu parler à cause des vaccins à ARNm COVID-19. Les LNP sont de petites bulles de graisse conçues pour transporter les instructions génétiques (sous forme d'ARNm) pour l'éditeur de base.[16][17]
Le Bon Côté : Les LNP ont un espace de chargement plus grand et sont moins susceptibles de déclencher une forte réponse immunitaire, ce qui signifie que la redose pourrait être possible.[2][16] Un grand avantage en matière de sécurité est qu'elles livrent des instructions temporaires. La cellule fabrique le "crayon", il fait son travail, puis les instructions et le crayon sont naturellement éliminés. Cette courte fenêtre d'activité réduit le risque de modifications non désirées.[18]
Les Défis : En ce moment, lorsqu'ils sont administrés par voie intraveineuse, la plupart des LNP sont naturellement absorbées par le foie.[19][20] Bien que cela soit parfait pour traiter les maladies du foie, les chercheurs travaillent dur pour concevoir de nouvelles LNP qui peuvent être dirigées vers d'autres tissus dans le corps.[16]
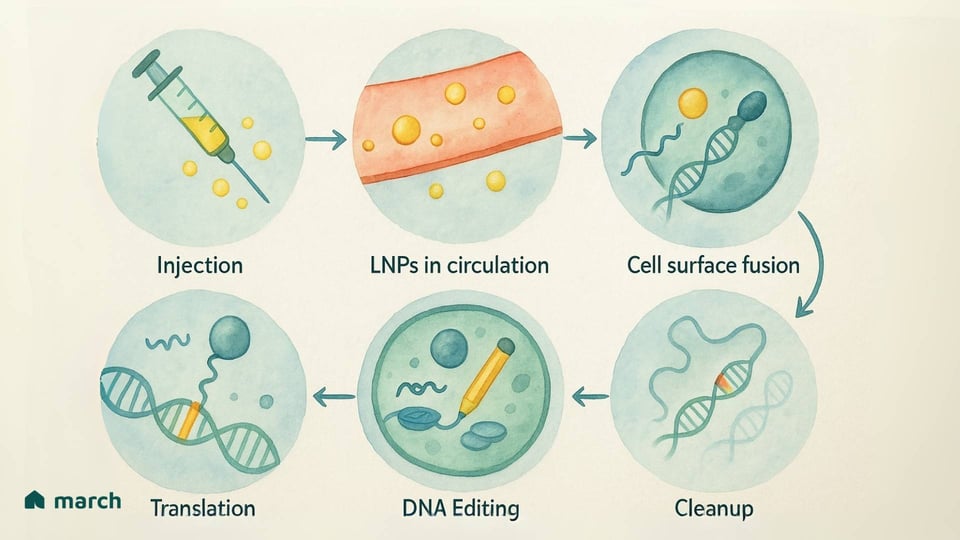
Les progrès sur ces systèmes de livraison sont tout aussi importants que les outils d'édition eux-mêmes. Chaque avancée pour rendre ces "camions" plus sûrs et mieux ciblés est un pas en avant pour notre communauté.
Un Moment Historique : Le Premier Humain à Recevoir l'Édition de Base In Vivo
Pendant des années, cette technologie était l'objet de recherches prometteuses dans les laboratoires. Mais récemment, nous avons assisté à un moment historique qui a fait passer cette technologie de la théorie à la réalité. L'histoire de K.J. Muldoon, un bébé né avec une maladie génétique rare sévère et menaçante pour la vie, a été une source d'inspiration incroyable.
K.J. a été diagnostiqué avec un déficit en synthétase de carbamoyl-phosphate 1 (CPS1), un trouble métabolique rare où le foie ne peut pas traiter l'ammoniac, un sous-produit toxique de la dégradation des protéines.[21][22] Cette condition peut être dévastatrice, avec un taux de mortalité estimé à 50 % dans la première infancy.[23] Nous savons la peur et l'incertitude qui accompagnent un tel diagnostic.
Mais la condition spécifique de K.J. était causée par une faute d'une lettre dans son ADN—un candidat parfait pour l'édition de base. Dans un effort remarquable, une thérapie personnalisée a été conçue juste pour lui en seulement six mois.[21] Il a reçu une infusion intraveineuse d'une LNP—la petite bulle de graisse—transportant les instructions d'ARNm pour un "crayon" éditeur de base conçu pour réparer sa mutation exacte.[24][25]
Les premiers résultats ont été une source de profonde espoir :[23]
K.J. a commencé à tolérer plus de protéines dans son alimentation.
La dose des médicaments nécessaires pour contrôler ses niveaux d'ammoniac a été réduite de manière significative.
Il a commencé à atteindre ses jalons de développement.
Plus puissamment, il a pu combattre deux virus infantiles courants sans plonger dans une crise menaçante pour la vie, quelque chose qui aurait été presque certain avant la thérapie.
Nous devons avancer sur ce chemin avec espoir et réalisme. Ceci était une thérapie pour un enfant courageux, et nous devons encore voir combien de temps la correction durera.[23] Mais cette unique histoire est une puissante preuve de concept. Elle montre que cette technologie est possible et a le potentiel de changer des vies. Elle ouvre également la porte à un avenir où des thérapies pourraient être adaptées à la composition génétique unique d'un individu.[24]
Ce n'est pas juste une histoire. La recherche est activement en cours pour d'autres conditions. Dans des modèles de laboratoire de la progeria, une maladie de vieillissement prématuré, l'édition de base a corrigé la faute génétique et a considérablement prolongé la durée de vie des souris. Des essais cliniques utilisant l'édition de base sont également en cours pour des conditions telles que l'hypercholestérolémie (dirigé par Verve Therapeutics) et le déficit en alpha-1 antitrypsine (dirigé par Beam Therapeutics).[26][27] Cette vague de recherche est motivée par les besoins de nombreuses communautés de patients différentes, et chaque succès crée un élan pour le suivant.
Avançons ensemble : Le chemin à venir
L'aube de l'édition de base in vivo est incroyablement excitante, mais en tant que communauté, nous savons que le progrès doit être réalisé de manière responsable et transparente. Il y a encore des défis significatifs à surmonter, et il est important d'en parler ouvertement.
La sécurité avant tout : La priorité absolue est de garantir que le "crayon" n'édite que la lettre ADN ciblée et rien d'autre. Les scientifiques ont développé des méthodes rigoureuses pour vérifier ces "modifications hors cible" et travaillent constamment pour rendre les outils encore plus précis.[9][28]
Comprendre les effets à long terme : Pour toute thérapie qui effectue un changement permanent, nous devons suivre les patients pendant une très longue période pour nous assurer que les bénéfices sont durables et qu'aucun problème inattendu ne surviennent à l'avenir.[10][29]
Le défi de l'accès : Nous savons que ces thérapies avancées sont actuellement incroyablement complexes et coûteuses à produire, certaines thérapies géniques coûtant plus de 2 millions de dollars par traitement.[30][31][32] En tant que communauté, il est vital que nous plaidions pour un avenir où ces traitements révolutionnaires soient accessibles à tous ceux qui en ont besoin, quel que soit l'endroit où ils vivent ou les ressources dont ils disposent.[33] C'est une conversation que nous devons avoir maintenant, dès le début.
Le domaine ne reste pas immobile. Les scientifiques développent déjà la prochaine génération d'outils, comme l'édition de prime, une autre innovation du laboratoire de Dr. Liu qui fonctionne comme une fonction "chercher et remplacer" pour l'ADN et peut corriger encore plus de types d'erreurs génétiques, y compris des insertions et des suppressions.[34][35][36][37][38][39]
Alors que nous observons cette nouvelle frontière de la médecine se déployer, nous nous engageons à vous fournir des informations claires et fiables. Nous célébrerons les percées et serons honnêtes sur les défis. Nous continuerons à construire une communauté où nous pouvons apprendre, partager et nous soutenir mutuellement. Vos perspectives, vos expériences et votre espoir sont ce qui alimente cette marche en avant. Sur ce chemin de découverte, vous n'êtes pas seul.
Pour un aperçu rapide, écoutez notre nouvel épisode de podcast, explorant l'histoire et la science de cette thérapie.
https://youtu.be/-aVHZciahbw
Sources
[7] Menichiello, T. (27 septembre 2023). Édition de base et édition de prime : comment elles transforment la thérapie génique. Cell & Gene.
[30] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024). Le prix abordable des traitements CRISPR est un impératif éthique pressant. CRISPR Journal.
[1] BioTechniques. (1 novembre 2017). Les crayons moléculaires réécrivent les bases.
[40] Verve Therapeutics. (2025). VERVE-102. Récupéré à vervetx.com.
[31] Glick, B. (8 décembre 2023). Les nouvelles thérapies géniques coûteuses pour la maladie de la cellule falciforme posent un test d'accès. BioPharma Dive.
[33] CRISPR Therapeutics Canada. (28 janvier 2025). Le véritable coût du traitement CRISPR : ce que les patients canadiens doivent savoir.
[8] Genethique. (2 novembre 2017). ABE (éditeur de base d'adénine) : un "éditeur de base" pour compléter l'arsenal CRISPR.
[21] Technology Networks. (27 juin 2025). Comment la première thérapie génique personnalisée a été créée en 6 mois.
[2] Open Access Journals. (n.d.). Problèmes rencontrés par les médecins dans la thérapie génique. Journal of Gene Therapy.
[41] Rare Disease Advisor. (15 avril 2025). Verve Therapeutics fait état de résultats prometteurs pour l'édition génique PCSK9 dans l'HeFH.
[12] Biocompare. (2 janvier 2025). Surmonter les défis dans les thérapies géniques basées sur AAV et rAAV.
[32] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (14 octobre 2024). Le prix abordable des traitements CRISPR est un impératif éthique pressant. ResearchGate.
[10] Consensus. (n.d.). Quels sont les défis du développement de thérapies géniques pour les troubles génétiques ?.
[14] Form Bio. (n.d.). Le rôle de AAV dans la thérapie génique.
[22] Sanders, R. (15 mai 2025). Un nourrisson né avec une maladie mortelle s'épanouit maintenant grâce à un traitement CRISPR personnalisé six mois après la naissance. Berkeley News.
[5] Ma, Y., et al. (2023). Édition précise du génome avec les éditeurs de base. Journal of Genetics and Genomics.
[34] Howard Hughes Medical Institute. (12 juin 2020). L'édition génomique de précision entre dans l'ère moderne.
[9] MedNexus. (2024). La thérapie génique ciblée : promesses et défis dans la gestion des maladies. Journal of Bio-X Research.
[15] BioInnovatise. (9 décembre 2024). Ressources sur la capacité d'emballage AAV.
[24] Ahn, N. (22 mai 2025). Des chercheurs de Penn Med, CHOP traitent un nourrisson avec la première thérapie génétique personnalisée au monde. The Daily Pennsylvanian.
[28] Frontiers in Pediatrics. (2024). Progrès et défis dans les stratégies de thérapie génique pour le cancer pédiatrique : une mise à jour complète.
[35] Rett Syndrome Research Trust. (n.d.). Édition de prime.
[29] Patsnap. (20 mars 2025). Quels sont les défis éthiques dans la thérapie génique ?.
[26] Taylor, N.P. (5 mai 2025). Un CRISPR "plus sûr" : l'édition de base fait ses preuves en clinique alors que Beam et Verve avancent. BioSpace.
[36] Cross, R. (2 décembre 2019). Introduction de CRISPR 3.0. C&EN Global Enterprise.
[23] Garcia de Jesus, E. (28 mai 2025). L'édition génique personnalisée a sauvé un bébé, mais l'avenir de la technologie est incertain. Science News.
[37] Synthego. (n.d.). Édition de prime comme outil d'édition génétique de précision.
[6] SCMP. (31 mai 2023). Des scientifiques chinois développent un nouvel outil d'édition génétique qui diffère dans son approche de CRISPR-Cas9.
[27] DeFeudis, N. (11 mars 2025). Beam partage des données cliniques prometteuses sur un traitement par édition génique pour une maladie pulmonaire et hépatique. Endpoints News.
[42] Wu, G. (24 mars 2025). Verve obtient l'approbation de la FDA pour élargir l'essai d'édition de base aux États-Unis. BioPharma Dive.
[3] Broad Institute. (5 avril 2025). David Liu reçoit le prix Breakthrough en sciences de la vie.
[4] Howard Hughes Medical Institute. (5 avril 2025). David Liu reçoit le prix Breakthrough.
[43] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024). Le prix abordable des traitements CRISPR est un impératif éthique pressant. Digital CSIC.
[13] High, K. A., & Roncarolo, M. G. (2019). Réponses immunitaires aux vecteurs AAV : surmonter les barrières à une thérapie génique réussie. Molecular Therapy.
[38] O'Hanlon Cohrt, K. (4 décembre 2023). Explication : Qu'est-ce que l'édition de prime et à quoi sert-elle ?. CRISPR Medicine News.
[44] O'Hanlon Cohrt, K. (14 mai 2025). Les dernières mises à jour des essais cliniques de CRISPR Medicine News.
[16] GenScript. (15 octobre 2024). Nanoparticules lipidiques : une percée dans les systèmes de livraison CRISPR.
[39] Davies, H., & Auguste, A. (2023). Édition du génome par base et édition de prime en oncologie de précision. Cancer Research.
[11] Revvity. (n.d.). Vecteurs AAV : défis et solutions pour la fabrication de thérapies géniques.
[45] Verve Therapeutics. (14 mai 2025). Verve Therapeutics annonce des progrès de pipeline et signale les résultats financiers du premier trimestre 2025.
[46] CRISPR Medicine News. (11 mars 2025). Beam Therapeutics fait état de données cliniques de preuve de concept pour BEAM-302 dans un essai sur le déficit en alpha-1 antitrypsine.
[47] Verve Therapeutics. (11 avril 2025). Verve Therapeutics reçoit la désignation de voie rapide par la FDA pour VERVE-102, un médicament d'édition de base in vivo ciblant PCSK9.
[48] Beam Therapeutics. (10 mars 2025). Beam Therapeutics annonce des données initiales positives pour BEAM-302 dans l'essai de phase 1/2 sur le déficit en alpha-1 antitrypsine (AATD), montrant la première correction génétique clinique d'une mutation causant une maladie.
[25] Children's Hospital of Philadelphia. (15 mai 2025). Premier patient traité avec une thérapie d'édition génétique CRISPR personnalisée à l'hôpital pour enfants de Philadelphie.
[17] ACS Publications. (20 mai 2022). Livraison de composants CRISPR/Cas9 basée sur nanoparticules lipidiques.
[18] PubMed Central (PMC). (n.d.). Les nanoparticules lipidiques : le changement de donne dans l'édition génomique CRISPR-Cas9.
[49] Promega Connections. (28 mai 2025). L'éclat de l'édition de base : le prix Breakthrough de David Liu et son impact.
[19] Nano Magazine. (19 décembre 2022). Livraison médiée par nanoparticules lipidiques de composants CRISPR pour l'édition du génome neuronal.
[20] ACS Nanoscience Au. (30 mars 2023). Progrès récents dans les nanoparticules lipidiques ciblant spécifiques pour la livraison d'ARNm.









