Pour de nombreux membres de notre communauté, le parcours avec le sarcome synovial commence non pas par la clarté, mais par une recherche frustrante et souvent longue de réponses.[1] Nous savons que ce chemin est souvent rempli d'incertitudes. Étant donné qu'il s'agit d'un cancer rare, affectant principalement les adolescents et les jeunes adultes (la population AYA), ses premiers symptômes—souvent une masse indolore et à croissance lente—sont fréquemment confondus avec quelque chose de plus commun, comme une blessure sportive ou un kyste.[2][4] Cela peut conduire à une "odyssée diagnostique" pouvant durer jusqu'à deux ans, un retard critique pour un cancer agressif.[1]
Ce diagnostic pèse sur les jeunes à un moment crucial de leur vie, perturbant l'éducation, les carrières et la planification familiale. Pendant des décennies, la voie à suivre pour ceux atteints d'une maladie avancée ou métastatique a été décourageante. Les régimes de chimiothérapie standard, bien que importants, ont offert un succès à long terme limité.[3] Pour les adultes diagnostiqués avec un sarcome synovial métastatique, le taux de survie global à cinq ans a été de 10% peu encourageant.[3] Les traitements de deuxième ligne comme le pazopanib ou le trabectedin, bien qu'offrant des options, offrent généralement des bénéfices modestes, avec une survie médiane globale d'environ 10 mois.[5] Il y a eu un besoin profond et profondément ressenti d'une véritable percée.
Mais aujourd'hui, nous voulons vous faire découvrir une histoire de progrès scientifique qui offre un nouveau type d'espoir. C'est une thérapie qui ne combat pas seulement le cancer, mais enseigne au corps du patient comment le faire. Nous parlons d'un nouveau traitement révolutionnaire appelé afamitresgene autoleucel, ou Tecelra.[11]
Ceci est une plongée approfondie dans la science, l'espoir et les défis réalistes de cette nouvelle frontière. Nous croyons qu'en comprenant cela, nous pouvons avoir des conversations plus éclairées avec nos équipes de soins, poser de meilleures questions et avancer ensemble avec une compréhension plus claire de ce que l'avenir peut réserver. Cette thérapie n'est pas seulement un nouveau médicament ; c'est un nouveau chapitre, celui qui touche au cœur même de ce qui rend le sarcome synovial unique.
La Science : Une serrure, une clé, et un soldat entraîné
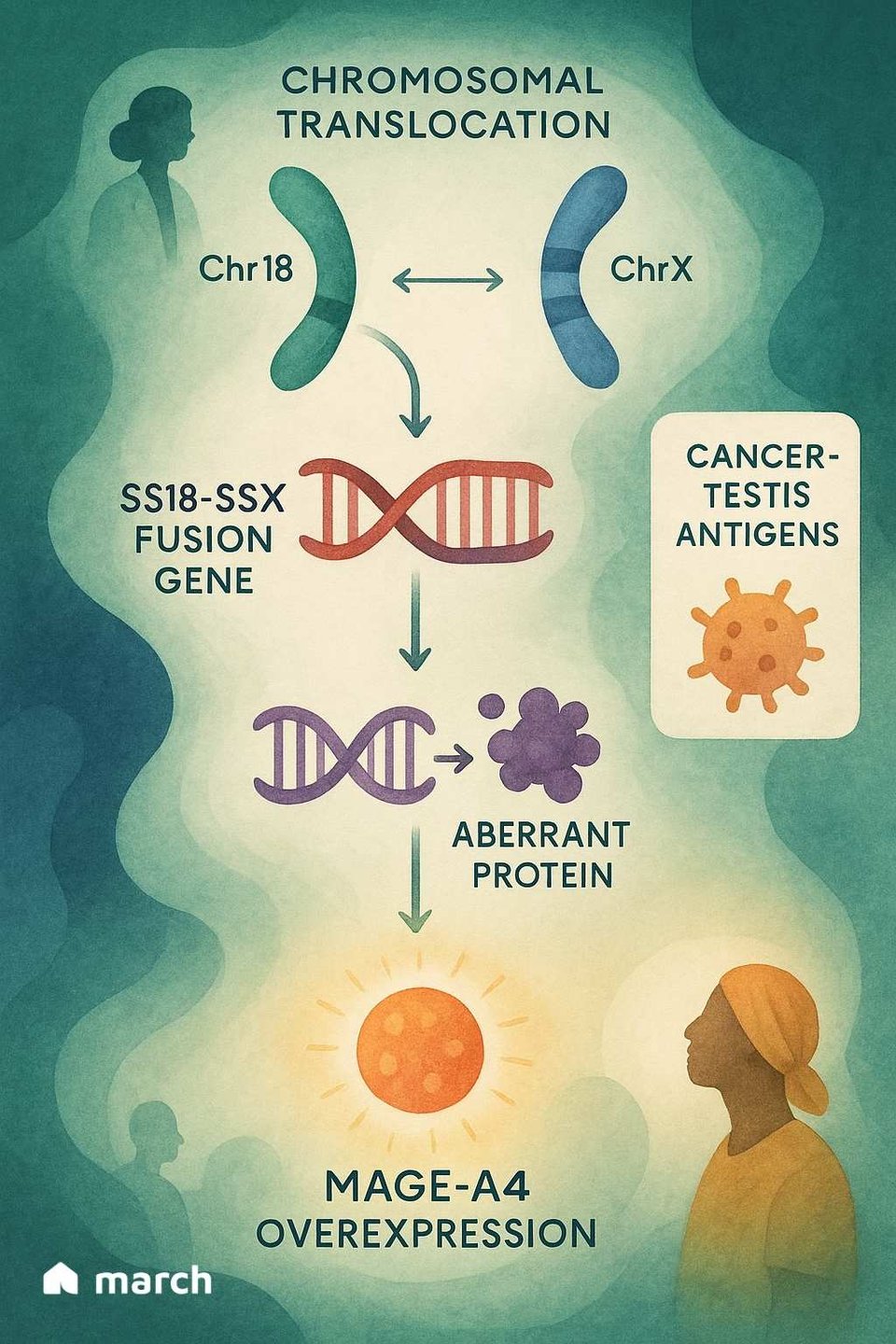
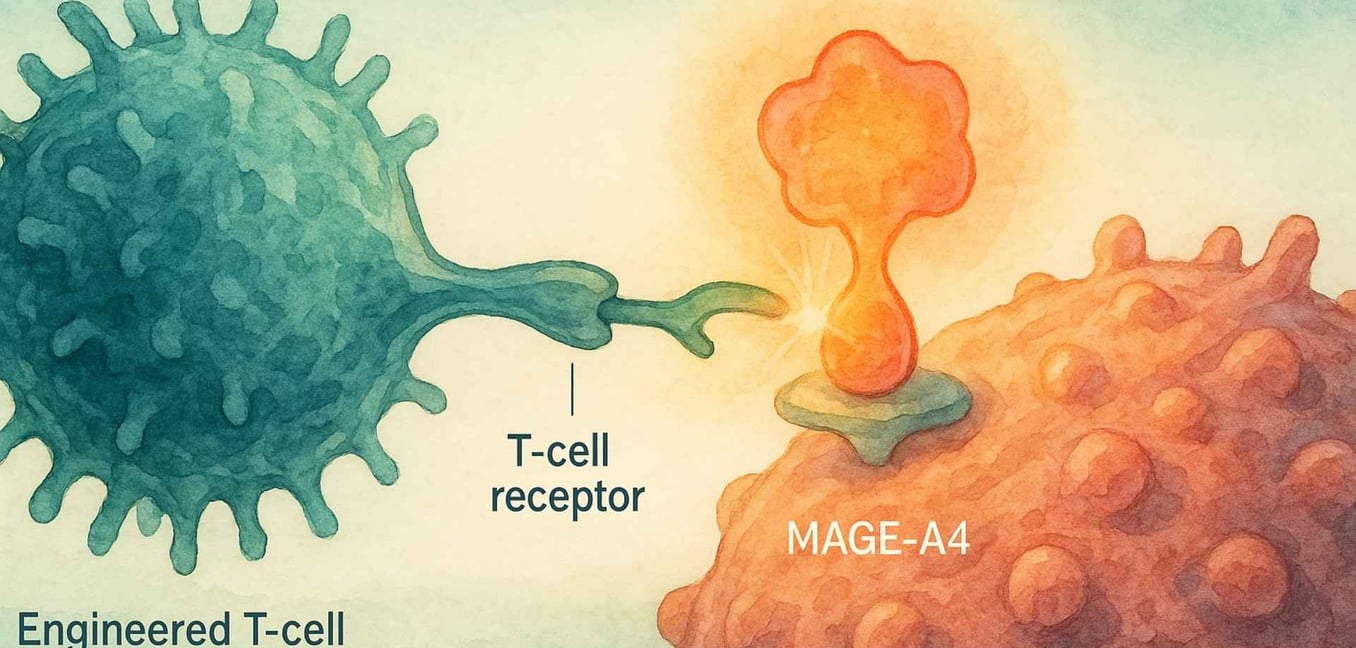
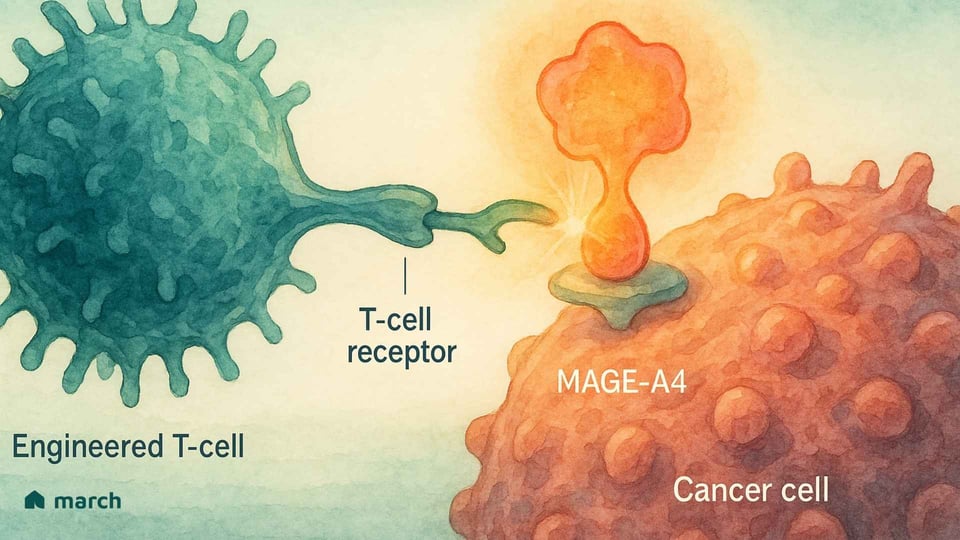
Pour vraiment saisir l'importance de Tecelra, nous devons commencer par la biologie unique du sarcome synovial lui-même. Contrairement à de nombreux cancers qui ont des centaines de mutations génétiques différentes, le sarcome synovial est souvent "mutationalement calme".[4] Plus de 95 % des cas sont causés par un événement génétique unique et spécifique : une translocation où des parties du chromosome 18 et du chromosome X échangent leurs places.[6][7] Cela crée un puissant et destructeur gène de fusion appelé SS18-SSX.[6]
Cette protéine de fusion SS18-SSX ne cause pas le cancer à elle seule ; au lieu de cela, elle pirate la machinerie interne de la cellule qui contrôle quels gènes sont activés ou désactivés.[6] L'une des conséquences de ce chaos génétique est que les cellules cancéreuses commencent à produire des protéines que les cellules adultes normales ne produisent pas, y compris une protéine appelée MAGE-A4.[8]
MAGE-A4 est un "antigène testiculaire du cancer," ce qui signifie qu'il se trouve normalement uniquement dans des sites à privilège immunitaire comme les testicules.[9] Lorsqu'il apparaît sur une cellule de sarcome, il agit comme un drapeau étranger, signalant au système immunitaire qu'il quelque chose ne va pas.[8] C'est ici que la stratégie élégante de Tecelra entre en jeu.
De la CAR-T au TCR : Cibler l'Intouchable
Beaucoup d'entre nous ont entendu parler de la thérapie CAR-T, qui a été révolutionnaire pour les cancers du sang.[10] Les cellules CAR-T sont modifiées pour reconnaître des cibles à la surface des cellules cancéreuses. Cependant, la grande majorité des protéines responsables du cancer, comme MAGE-A4, se trouvent à l'intérieur de la cellule, les rendant invisibles aux CAR-T.[20]
C'est là que vient la thérapie avec le récepteur des cellules T (TCR). Toutes nos cellules utilisent un système appelé complexe HLA pour montrer constamment au système immunitaire des morceaux des protéines en elles.[13] Si une cellule est cancéreuse, elle affichera des fragments de protéines cancéreuses à sa surface. La thérapie TCR T-cell modifie les cellules T du patient pour reconnaître ces fragments très spécifiques.[20]
Tecelra est la première thérapie TCR approuvée par la FDA pour une tumeur solide, un véritable accomplissement marquant.[11] Cela fonctionne car cela résout deux problèmes à la fois :
La serrure (la cible) : Elle donne aux cellules T du patient un TCR nouveau et de haute affinité, spécialement conçu pour trouver le fragment protéique MAGE-A4.[13]
La clé (la poignée de main) : Elle ne peut "voir" ce fragment que s'il est présenté par une molécule HLA spécifique, HLA-A*02.[13]
Ce système de reconnaissance en deux parties—la "serrure" MAGE-A4 et la "clé" HLA-A*02—rend la thérapie incroyablement précise, mais aussi hautement personnalisée.[13] Elle ne fonctionnera que pour les patients qui ont ces deux marqueurs biologiques.[14]
Le processus Tecelra : Le parcours du patient vers un médicament vivant
Comprendre la science est une chose ; savoir ce que le parcours implique réellement en est une autre. Le processus de réception de Tecelra est intensif et nécessite un engagement significatif des patients et de leurs soignants. C'est un chemin en plusieurs étapes qui transforme les propres cellules du patient en un médicament vivant puissant.
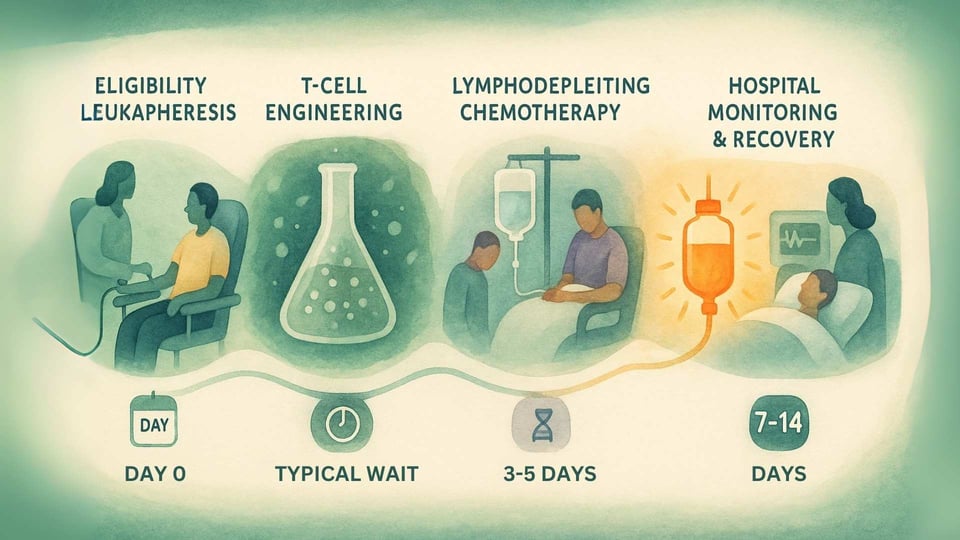
Étape 1 : Confirmation et collecte (leucaphérèse)
Le parcours commence par des tests pour s'assurer qu'un patient est éligible. Cela implique un test sanguin pour confirmer qu'il a le marqueur génétique HLA-A*02 requis et un test de biopsie de sa tumeur pour confirmer qu'elle exprime la protéine MAGE-A4.[14] Une fois l'éligibilité confirmée, le patient subit une leucaphérèse, une procédure non chirurgicale qui filtre les cellules T de son sang.[12]
Étape 2 : L'attente de fabrication
Les cellules T collectées sont congelées et envoyées dans une installation de fabrication spécialisée. Ici, elles subissent le processus d'ingénierie génétique pour devenir Tecelra.[13] C'est un processus complexe et minutieux qui, dans l'essai clinique, a pris en moyenne 40 jours.[14] Pendant cette période d'attente, le médecin du patient peut recommander une "thérapie de pont", comme la chimiothérapie, pour garder le cancer sous contrôle.[14]
Étape 3 : Préparation du corps (lymphodéplétion)
Quelques jours avant l'infusion, le patient est admis à l'hôpital pour recevoir une chimiothérapie lymphodéplétante (généralement fludarabine et cyclophosphamide).[14] Le but de cette chimiothérapie n'est pas de tuer le cancer, mais de réduire temporairement le nombre de cellules immunitaires existantes dans le corps.[15] Cela crée un environnement clair et accueillant pour que les nouvelles cellules T modifiées s'engagent, s'étendent et persistent pour un effet durable.[15]
Étape 4 : L'infusion (Jour Zéro)
Après la lymphodéplétion, le patient reçoit ses cellules Tecelra personnalisées par une seule infusion intraveineuse (IV).[14] Ce moment est souvent appelé "Jour Zéro", marquant le début de la lutte de son nouveau système immunitaire contre le cancer.
Étape 5 : Surveillance intensive et soutien
La période post-infusion est la plus critique. Étant donné que la thérapie est conçue pour créer une réponse immunitaire puissante, les patients doivent être surveillés à l'hôpital pendant au moins 7 jours.[14] Ils sont également conseillés de rester proches du centre de traitement spécialisé pendant au moins 4 semaines. Reconnaissant le fardeau logistique et financier, le fabricant propose un programme de soutien, AdaptimmuneAssist, qui peut aider les patients éligibles avec les frais de voyage, de logement et d'autres coûts personnels.[16]
Une histoire racontée en données : L'espoir de l'essai SPEARHEAD-1
Pendant des années, cette science remarquable a été un concept recherché dans les laboratoires. Mais l' essai clinique SPEARHEAD-1 l'a fait passer de la théorie à la réalité, offrant un espoir tangible à 44 personnes atteintes de sarcome synovial avancé qui avaient déjà subi en moyenne trois lignes de thérapie systémique précédentes.[14][17] Ces patients pour qui les options standard ne fonctionnaient plus. Les résultats, publiés dans la prestigieuse revue The Lancet, étaient une source d'incroyable encouragement.[14]
Examinons les chiffres, car ils racontent une histoire puissante d'espoir :
Une réponse significative (ORR) : Dans ce groupe fortement prétraité, 43 % des patients ont vu leurs tumeurs diminuer en réponse à l'infusion unique de Tecelra.[11][14] C'est ce qu'on appelle le taux de réponse global (ORR), et c'est un chiffre significatif où les thérapies de deuxième ligne ont souvent des taux de réponse bien inférieurs à 20 %.
Bénéfices durables et prolongés (DoR) : Pour ceux qui ont répondu à la thérapie, les effets étaient souvent durables. La durée médiane de réponse (DoR) était de 6.0 mois.[14] Crucialement, 39 % de ceux qui ont répondu continuaient à bénéficier de cet effet un an plus tard, suggérant un effet durable à long terme pour un groupe significatif.[14]
La "queue de la courbe" (Survie globale) : Peut-être la découverte la plus puissante a été ce qui est arrivé aux patients qui ont répondu à Tecelra à long terme. Pour l'ensemble du groupe de patients atteints de sarcome synovial, la survie globale médiane (OS) était d'environ 17 mois.[14] Mais pour ceux dont le cancer a répondu à la thérapie, la survie globale médiane n'avait pas encore été atteinte, et une estimation de 70 % de ces répondants étaient encore en vie au bout de deux ans.[14] Cela crée ce que les chercheurs appellent une "queue de la courbe de survie". Cela suggère que pour un sous-groupe de patients, ce médicament vivant n'est pas seulement une solution temporaire ; il a le potentiel de fournir une défense durable à long terme contre le cancer, changeant fondamentalement leur perspective.
Pour une communauté qui a attendu plus d'une décennie un nouvel option thérapeutique, ces résultats représentent une avancée monumentale et émotionnelle. C'est le genre de progrès qui montre que la science est à l'écoute, et que les besoins des patients atteints de maladies rares conduisent l'innovation.
Le chemin à venir : Réalisme, responsabilité et l'horizon
Nous parcourons ce chemin avec vous, tenant à la fois espoir et honnêteté. C'est une thérapie puissante, et il est crucial de comprendre les effets secondaires significatifs. Parce qu'il est conçu pour activer puissamment le système immunitaire, Tecelra est assorti d'un avertissement en boîte aux États-Unis concernant deux toxicités principales, potentiellement mortelles : [11]
Syndrome de libération de cytokines (CRS) : Cela a été l'effet secondaire grave le plus commun, survenant chez 75 % des patients dans l'essai.[14] Le CRS est une réponse inflammatoire systémique qui peut provoquer de fortes fièvres, des nausées, une hypotension et d'autres symptômes. Bien que la plupart des cas soient légers à modérés et puissent être gérés efficacement avec des soins de soutien et des médicaments, 2% des patients ont éprouvé un CRS sévère (grade 3 ou supérieur). [14]
Syndrome de neurotoxicité associé aux cellules effectrices immunitaires (ICANS) : C'est un effet secondaire neurologique plus rare, observé chez environ 2 % des patients à faible degré.[14]
Ces risques sont précisément la raison pour laquelle Tecelra ne peut être administré que dans des centres de traitement autorisés spécialisées avec des équipes parfaitement formées.[18]
L'arrivée de Tecelra est vraiment une nouvelle aube, mais nous savons que ce n'est pas la fin du voyage. La conversation autour des thérapies avancées doit inclure les défis d'accès et de coût. Avec un prix affiché de 727 000 dollars, garantir l'accès équitable est un défi éthique et pratique majeur pour notre système de santé.[19] En tant qu'intervenants, nous devons continuer à défendre un avenir où chaque personne éligible puisse en bénéficier.
L'histoire de Tecelra est plus qu'un simple médicament. Il s'agit de la marche inlassable de la science, et cela ouvre la porte à de futures innovations. La recherche est déjà en cours pour explorer d'autres cibles, comme l'antigène NY-ESO-1, et des TCR de nouvelle génération conçus pour être encore plus efficaces.[20]
Alors que nous suivons cette nouvelle frontière se déployer, nous nous engageons à vous fournir des informations claires et fiables. Vos insights, vos expériences et votre espoir alimentent cette marche en avant. Dans ce voyage de découverte, vous n'êtes pas seul.
Sources
Aytekin, M. N., et al. (2022). Le "grand trompeur" en orthopédie : sarcome synovial. Cureus.
Orphanet. (n.d.). Sarcome synovial.
Institut National du Cancer. (n.d.). Traitement du sarcome synovial (PDQ®) - Version pour les professionnels de la santé.
King, D.M., et al. (2020). Une revue du sarcome synovial. Journal de l'American Academy of Orthopaedic Surgeons.
Martin-Broto, J., et al. (2022). Pazopanib et Trabectedin pour les patients atteints de sarcome synovial métastatique : une étude en conditions réelles. Cancers.
Lagarde, P., et al. (2016). La protéine oncogène SS18-SSX de fusion. The Journal of Pathology.
PathologyOutlines.com. (n.d.). Sarcome synovial - Moléculaire.
Saito, T., et al. (2023). MAGE-A4 est une cible thérapeutique potentielle dans le sarcome synovial. Oncology Reports.
Institut de recherche sur le cancer. (n.d.). Antigènes testiculaire-cancer.
Institut National du Cancer. (n.d.). Thérapie CAR T-cell et ses effets secondaires.
U.S. Food and Drug Administration. (2024). La FDA accorde une approbation accélérée à afamitresgene autoleucel.
Institut National du Cancer. (n.d.). Leucaphérèse. NCI Dictionary of Cancer Terms.
Adaptimmune. (n.d.). Notre technologie.
D'Angelo, S. P., et al. (2024). Afamitresgene autoleucel pour le sarcome synovial avancé (SPEARHEAD-1). The Lancet.
Jain, T., et al. (2019). Thérapie CAR T-cell : Le rôle de la lymphodéplétion. The Hematologist.
Adaptimmune. (n.d.). AdaptimmuneAssist.
D'Angelo, S. P., et al. (2021). Afamitresgene autoleucel pour le sarcome synovial avancé ou le liposarcome myxoïde/ronde. ASCO Post.
Adaptimmune. (n.d.). Centres de traitement autorisés.
Leo, L. & Sunny, S.E. (2024). La FDA des États-Unis approuve la thérapie génique d'Adaptimmune pour un cancer rare. Reuters.
Ma, S., et al. (2021). Paysage actuel de la thérapie T-cell récepteur-ingénieur pour les tumeurs solides. Journal of Hematology & Oncology.