
Pour tant de familles dans notre communauté, le parcours avec une maladie ultra-rare commence par un point d'interrogation. C'est un chemin qui implique souvent une longue et frustrante recherche de réponses - une "odyssée diagnostique" - et mène à une vie de gestion de symptômes complexes sans une thérapie qui aborde la racine du problème. Nous savons que ce parcours peut être incroyablement difficile, et nous voulons que vous sachiez que sur ce chemin, vous n'êtes pas seul.
Aujourd'hui, nous voulons vous accompagner à travers une histoire de progrès scientifiques incroyables qui apporte un nouveau chapitre d'espoir pour une telle condition : le syndrome WHIM.
C'est une plongée approfondie dans la science, les défis, et les progrès marquants qui ont conduit à la première thérapie jamais conçue spécifiquement pour ce trouble rare. Nous croyons que, en comprenant le voyage de la découverte au traitement, nous pouvons avoir des conversations plus éclairées, poser de meilleures questions et avancer ensemble avec une idée plus claire de ce que l'avenir réserve à nos communautés.
Qu'est-ce que le syndrome WHIM ? Une histoire en un acronyme
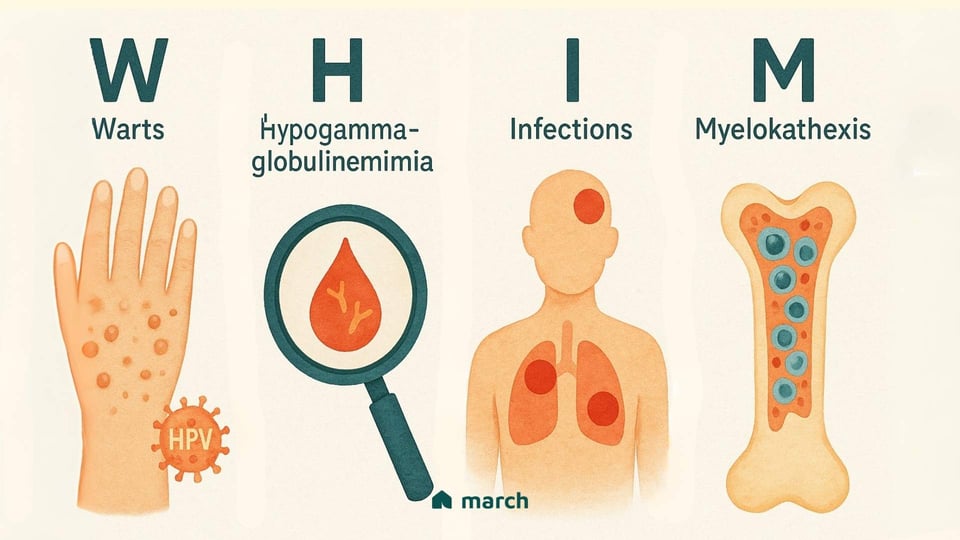
Le syndrome WHIM est une immunodéficience primaire génétique extrêmement rare, et son nom est un acronyme qui raconte l'histoire de ses principales caractéristiques :[1]
Verrues : Les patients présentent souvent des verrues sévères, persistantes et répandues causées par une susceptibilité inhabituelle au virus du papillome humain (VPH).
Hypogammaglobulinémie : Cela signifie avoir de faibles niveaux d'immunoglobulines (anticorps) dans le sang, qui sont les outils essentiels du corps pour lutter contre les bactéries et autres germes.
Infections : La combinaison de défis du système immunitaire entraîne des infections bactériennes récurrentes et souvent graves, telles que la pneumonie, la sinusite et les infections cutanées.
Myélokathexis : C'est le terme scientifique pour la caractéristique inhabituelle et définissante du WHIM. Cela décrit une situation où les principales cellules immunitaires de combat contre les infections, en particulier les neutrophiles, se retrouvent "piégées" dans la moelle osseuse et ne peuvent pas sortir dans la circulation sanguine pour faire leur travail.[2]
Imaginez que les meilleurs soldats de votre corps sont tous entraînés et prêts pour le combat, mais ils sont bloqués derrière une porte verrouillée dans la caserne, incapables d’atteindre les lignes de front.[3] C'est le problème central du syndrome WHIM. La moelle osseuse est remplie de cellules immunitaires saines et matures, mais le reste du corps reste vulnérable.
La racine du défi : une "sonnette" suractive dans le système immunitaire
Alors, qu'est-ce qui maintient cette porte verrouillée ? Pendant des décennies, cela a été un mystère. Mais en 2003, les chercheurs ont fait une découverte révolutionnaire : le syndrome WHIM est causé par une mutation dans un seul gène appelé CXCR4.[4]
Ce gène fournit les instructions pour un récepteur qui agit comme une "sonnette" cellulaire. Il se trouve sur la surface des cellules sanguines blanches et son principal rôle est de recevoir un signal d'une molécule appelée CXCL12. Ce signal dit essentiellement aux cellules sanguines blanches de rester dans l'environnement sûr et nourrissant de la moelle osseuse.[5]
Chez une personne en bonne santé, cette sonnette sonne, la cellule reçoit le message "restez ici" et ensuite la sonnette se désactive rapidement. Cela permet aux cellules de quitter la moelle osseuse lorsqu'elles sont appelées à agir pour combattre une infection.
Dans le syndrome WHIM, la mutation provoque un “gain de fonction.” Cela signifie que la sonnette CXCR4 est hyperactive - elle est essentiellement coincée en position "on".[6] Elle envoie en permanence le signal pour que les cellules restent sur place, même lorsqu’il n’y a aucun signal actif leur indiquant de le faire.
C'est la cause directe de la myélokathexis. Le signal incessant "restez ici" du récepteur CXCR4 défectueux est ce qui verrouille la porte, piégeant les neutrophiles et lymphocytes matures dans la moelle osseuse. Là, ils finissent par vieillir et mourir sans jamais atteindre les parties du corps qui en ont désespérément besoin. Ce simple erratum génétique est ce qui conduit aux faibles numéros de globules blancs (neutropénie et lymphopénie) qui causent les infections récurrentes et d'autres symptômes du WHIM.
Le chemin vers une solution : de la gestion des symptômes à la ciblage de la cause
Pendant des décennies, la gestion du syndrome WHIM signifiait traiter les conséquences de la porte verrouillée, et non le verrou lui-même. Ce soin de soutien a été, et continue d'être, une bouée de sauvetage vitale pour les patients.
Les injections de facteur stimulant les granulocytes (G-CSF) peuvent aider à pousser plus de neutrophiles hors de la moelle osseuse, mais ce traitement ne traite pas le problème sous-jacent avec d'autres cellules immunitaires et peut comporter des risques à long terme.[1]
Les perfusions d'immunoglobulines (IVIG) peuvent fournir au corps des anticorps empruntés pour aider à lutter contre les infections, mais il s'agit d'une solution temporaire qui nécessite des perfusions lourdes à vie.
Ce sont des outils incroyablement importants, mais ce sont des “solutions de contournement.” Elles ne corrigent pas la sonnette défectueuse. La communauté a depuis longtemps besoin d'une thérapie qui pourrait traiter directement la cause génétique profonde de la maladie.
Un moment marquant : l'arrivée de Mavorixafor (XOLREMDI®)
Après des années de recherche dédiée, un moment marquant est arrivé. En avril 2024, la FDA américaine a approuvé mavorixafor (nom de marque XOLREMDI®), la première et seule thérapie conçue spécifiquement pour cibler le mécanisme sous-jacent du syndrome WHIM pour les patients âgés de 12 ans et plus.[7]
Revenons à notre analogie. Si le problème est une sonnette suractive, mavorixafor fonctionne en recouvrant temporairement celle-ci.
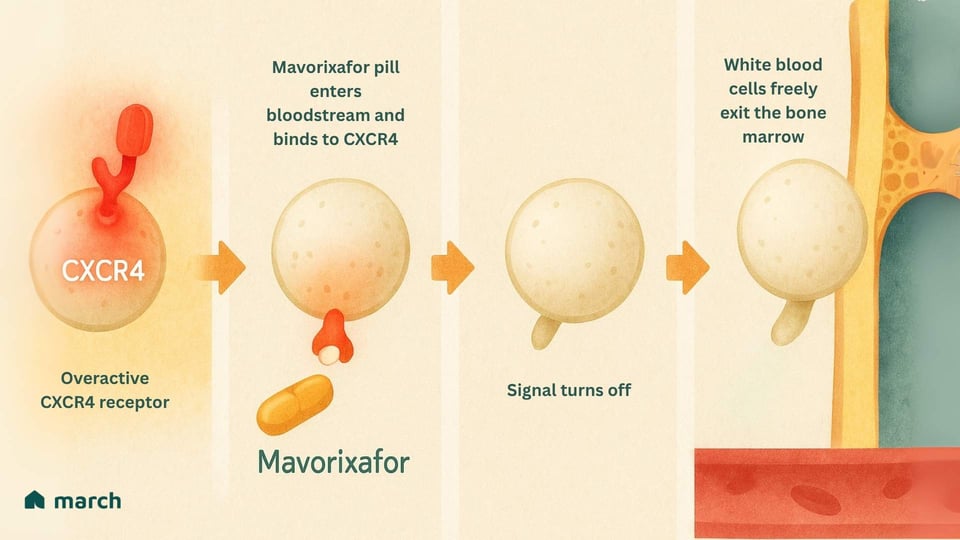
Mavorixafor est un médicament oral qui est un antagoniste du CXCR4. Cela signifie qu'il se lie au récepteur CXCR4 et le bloque, l'empêchant d'envoyer en permanence son signal "restez ici".[8]
En interrompant ce signal, il "déverrouille la porte". Les neutrophiles et lymphocytes piégés sont enfin libérés de la moelle osseuse et peuvent entrer dans la circulation sanguine pour patrouiller contre les infections et protéger le corps.[7]
Les résultats de la phase 3 clinique pivot ont été une source d'espoir profond pour la communauté. Les patients prenant mavorixafor ont constaté :[9]
Une augmentation statistiquement significative de la durée durant laquelle leurs numéros de neutrophiles et de lymphocytes étaient au-dessus des niveaux nécessaires pour lutter contre les infections.
Plus puissamment, une réduction de 60 % du taux d'infections graves par rapport à ceux prenant un placebo.
Cela représente un pas monumental en avant : un changement d'une simple gestion des conséquences de la maladie à une intervention active à sa source.
Avancer ensemble : espoir, réalisme, et le chemin à venir
L'approbation d'une thérapie ciblée pour une maladie ultra-rare est une victoire pour toute la communauté des maladies rares. C'est un témoignage de la résilience des patients et des familles qui participent à des essais cliniques, et de la dévotion des chercheurs et des défenseurs qui soutiennent le progrès.
En même temps, en tant que communauté, nous parcourons ce chemin avec à la fois espoir et honnêteté. C'est un pas énorme, mais ce n'est pas la fin du parcours. Dans son essai principal, la thérapie n'a pas montré d'amélioration significative de la charge de verrues, et son approbation concerne actuellement les patients de 12 ans et plus, ce qui met en avant un besoin continu de recherche chez les jeunes enfants.[9,10] Mavorixafor est une thérapie de gestion quotidienne à vie, pas un remède unique, et nécessite une adhésion rigoureuse.
C'est ce à quoi ressemble l'avancée du progrès. C'est une étape dédiée et significative qui peut réduire considérablement la charge des infections et transformer la façon dont une maladie est gérée. Et cela inspire la prochaine vague d'innovation. L'histoire remarquable d'une patiente qui a été spontanément guérie du WHIM lorsqu'un accident génétique a supprimé son gène CXCR4 défectueux a fourni une preuve naturelle de concept pour un potentiel remède, suscitant des recherches sur les thérapies géniques qui pourraient un jour répliquer ce résultat intentionnellement.[11]
Alors que nous observons ces nouvelles frontières de la médecine se déployer, nous nous engageons à vous fournir des informations claires et fiables. Nous célébrerons les percées et serons honnêtes sur les défis qui subsistent. Nous continuerons à construire une communauté où nous pourrons apprendre, partager et nous soutenir mutuellement. Vos idées, vos expériences, et votre espoir sont ce qui alimente cette avancée. Sur ce chemin de découverte, vous n'êtes pas seul.
Pour un aperçu rapide d'une autre percée scientifique, écoutez notre dernier épisode de podcast, qui explore l'histoire et la science derrière les nouveaux traitements d'édition génique.
Sources
[1] Organisation nationale pour les troubles rares (NORD). (n.d.). Syndrome WHIM.
[2] Zuelzer, W. W. (1964). "Myélokathexis" - une nouvelle forme de granulocytopénie chronique. New England Journal of Medicine.
[3] Dale, D. C., et al. (2020). L'antagoniste CXCR4 mavorixafor chez les patients atteints du syndrome WHIM. Blood.
[4] Hernandez, P. A., et al. (2003). Les mutations dans le gène du récepteur de chimiokines CXCR4 sont associées au syndrome WHIM, une maladie combinée d'immunodéficience. Nature Genetics.
[5] X4 Pharmaceuticals. (2024). Informations de prescription de XOLREMDI (mavorixafor).
[6] Balabanian, K., et al. (2005). Les syndromes WHIM avec différentes anomalies génétiques sont expliqués par une désensibilisation et une internalisation altérées du CXCR4. Blood.
[7] Badalato, R., et al. (2024). Mavorixafor pour le traitement du syndrome WHIM : un essai randomisé de phase 3 contrôlé par placebo. The Lancet.
[8] McDermott, D. H., et al. (2019). L'antagoniste CXCR4 plerixafor corrige la panleucopénie et prévient les infections bactériennes dans le syndrome WHIM. Blood.
[9] X4 Pharmaceuticals. (29 avril 2024). X4 Pharmaceuticals annonce l'approbation de la FDA américaine de XOLREMDI™ (mavorixafor). [Communiqué de presse].
[10] U.S. Food & Drug Administration (FDA). (2024). Approbations de nouveaux médicaments pour 2024.
[11] McDermott, D. H., et al. (2015). La guérison chromothriptique du syndrome WHIM. Cell.










Sadaf boostan
•il y a 3 mois, 4 semaines
Super
Report Comment
You are about to report:
Sadaf boostan
sadaf sadaf
•il y a 3 mois
Génial
Report Comment
You are about to report:
sadaf sadaf