Per molte famiglie nella nostra comunità, il percorso con una malattia genetica rara inizia con un singolo, piccolo errore nel manuale delle istruzioni del corpo—il nostro DNA. Sappiamo che comprendere la scienza dietro a queste condizioni può essere uno dei primi passi verso la sensazione di potere. Per decenni, i trattamenti si sono concentrati sulla gestione dei sintomi piuttosto che sull'affrontare la causa del problema. Ma oggi, vogliamo camminare con te attraverso uno sviluppo che rappresenta un nuovo capitolo di speranza, una storia di straordinari progressi scientifici che toccano il cuore stesso di queste condizioni.
Stiamo sentendo di più riguardo a una tecnologia rivoluzionaria chiamata editing di base in vivo. Sappiamo che questi termini scientifici possono sembrare intimidatori, quindi il nostro obiettivo qui è spezzettarli insieme. Questa è una storia che parla di passare da grandi cambiamenti nel nostro DNA a cambiamenti incredibilmente precisi. Si tratta di un nuovo tipo di "cancello molecolare" che offre un approccio più delicato e mirato per correggere l'originale errore genetico.[1]
Questo è un'immersione profonda nella scienza, nella speranza e nelle sfide realistiche di questo nuovo fronte. Crediamo che, comprendendolo, possiamo avere conversazioni più informate, porre domande migliori e avanzare insieme con una visione più chiara di ciò che il futuro potrebbe riservare.
Da forbici molecolari a una matita genetica: l'evoluzione dell'editing genetico
Per comprendere il progresso dell'editing di base, è utile guardare prima alla tecnologia che l'ha preceduto: CRISPR-Cas9. Potresti aver sentito parlare di CRISPR descritto come “forbici molecolari.”[1] È stata una scoperta rivoluzionaria che ha dato agli scienziati la possibilità di trovare un punto specifico nel nostro DNA e fare un taglio. Questo è stato un salto monumentale in avanti, consentendo ai ricercatori di "disattivare" geni difettosi. Questa tecnologia è la base per la prima terapia approvata basata su CRISPR per la malattia delle cellule falciformi, Casgevy, in cui le cellule vengono prelevate dal corpo, modificate con queste forbici e poi restituite al paziente.
Pur sendo incredibilmente potente, l'idea di effettuare un taglio a doppio filamento nel nostro DNA è sempre stata accompagnata da sfide. Il processo di riparazione naturale della cellula per tale taglio può essere un po' imprevedibile, portando talvolta a modifiche indesiderate.[2] Sappiamo che per qualsiasi terapia possa essere utilizzata su larga scala, soprattutto all'interno del corpo, la sicurezza è la massima priorità.
Qui entra in gioco l'editing di base, rappresentando il passo successivo in questo percorso di progresso. Sviluppato da ricercatori, incluso un team guidato da Dr. David Liu presso l'Università di Harvard e il Broad Institute, l'editing di base è stato progettato per essere più simile a una “matita molecolare.”[3][4] È stato creato per apportare una modifica precisa a una singola lettera del codice del DNA senza effettuare un taglio distruttivo.[5][6]
Ecco come possiamo immaginarne il funzionamento:
La Guida: Una molecola chiamata RNA guida (gRNA) agisce come un GPS, conducendo l'editor di base al "typo" esatto e specifico nei miliardi di lettere che compongono il nostro DNA.[1]
L'Ancora: L'editor di base utilizza una proteina CRISPR disattivata (spesso chiamata nickase o "dead" Cas9) come un'ancora. Si tiene attaccato al DNA nel posto giusto ma—e questo è il punto chiave—non effettua un taglio a doppio filamento.[5][7]
La Matita: Fusa a questa ancora c'è un enzima speciale (una deaminasi) che agisce come la matita. Esegue una reazione chimica che effettivamente cancella la lettera del DNA errata e la sostituisce con quella corretta.[7][8]
La bellezza di questo approccio è la sua precisione e la sua natura delicata. Evitando un taglio, elude molte delle preoccupazioni associate alle originali “forbici molecolari”, offrendo un modo potenzialmente più sicuro per correggere gli errori genetici fondamentali che causano così tante malattie rare.[1][9]
La Sfida della Consegna: Portare la Matita alla Pagina Giusta
Avere una "matita genetica" straordinaria è una cosa, ma portarla alle cellule giuste in profondità dentro il corpo è una delle maggiori sfide in tutta la terapia genica.[2][10] Questo è il "in vivo" del puzzle—effettuare le modifiche all'interno del corpo vivente. Per molte condizioni che colpiscono organi come il fegato, il cervello o i muscoli, questo è l'unico modo in cui una terapia genetica può funzionare.
Gli scienziati stanno lavorando instancabilmente su questo problema di consegna e due approcci principali sono emersi come i favoriti. Pensali come due diversi tipi di camion microscopici per la consegna:
Vettori Virali (come AAV): Questi sono essenzialmente i gusci di virus che sono stati svuotati e riprogettati in modo tale da non poter causare malattie. Invece, sono riempiti con le istruzioni genetiche per fabbricare l'editor di base.
Il Lato Positivo: I virus sono naturalmente molto bravi a entrare nelle nostre cellule, e diversi tipi di Virus Associati all'Adeno (AAV) sono noti per mirare a tessuti specifici come i muscoli o gli occhi.[11] Hanno una lunga storia nella ricerca sulla terapia genica.
Le Sfide: Sappiamo che i nostri corpi sono progettati per combattere i virus. Questo significa che molte persone hanno un'immunità preesistente che potrebbe fermare il vettore prima che faccia il suo lavoro.[12][13] Questa risposta immunitaria rende anche difficile somministrare una seconda dose.[12] Inoltre, gli AAV hanno uno "spazio di carico" limitato di circa 4,7 kilobasi, il che può essere un po' stretto per la macchina di editing di base.[14][15]
Nanoparticelle Lipidiche (LNP): Potresti aver sentito parlare di queste dai vaccini mRNA COVID-19. Le LNP sono minuscole bolle di grasso ingegnerizzate che possono trasportare le istruzioni genetiche (sotto forma di mRNA) per l'editor di base.[16][17]
Il Lato Positivo: Le LNP hanno uno spazio di carico maggiore e sono meno propense a scatenare una forte risposta immunitaria, il che significa che potrebbe essere possibile ripetere il dosaggio.[2][16] Un grande vantaggio in termini di sicurezza è che forniscono istruzioni temporanee. La cellula produce la "matita", svolge il suo compito e poi le istruzioni e la matita vengono naturalmente eliminate. Questa breve finestra di attività riduce il rischio di modifiche indesiderate.[18]
Le Sfide: In questo momento, quando somministrate tramite un'infusione endovenosa, la maggior parte delle LNP viene naturalmente assorbita dal fegato.[19][20] Anche se questo è perfetto per trattare le malattie epatiche, i ricercatori stanno lavorando duramente per ingegnerizzare nuove LNP che possano essere dirette verso altri tessuti nel corpo.[16]
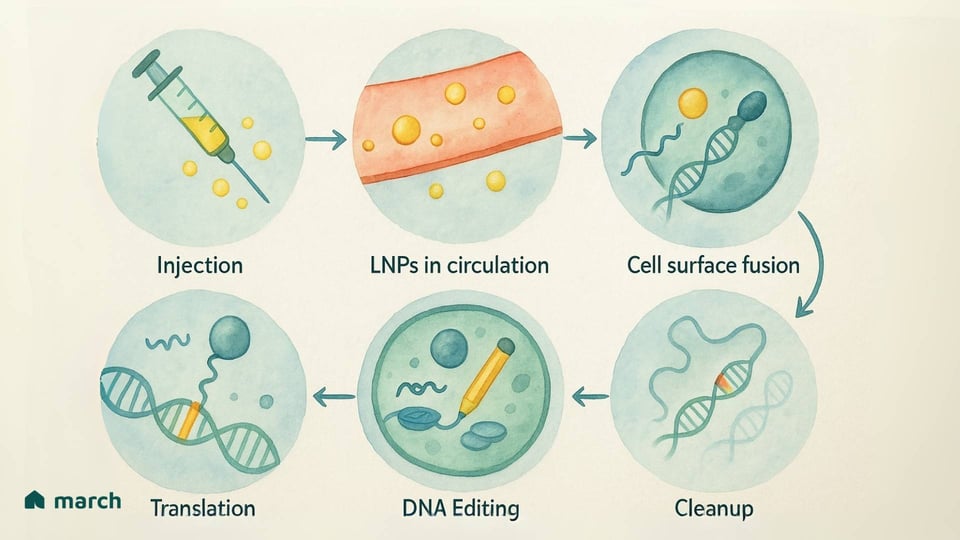
I progressi su questi sistemi di consegna sono altrettanto importanti degli strumenti di editing stessi. Ogni passo avanti nel rendere questi "camion" più sicuri e mirati è un passo avanti per la nostra comunità.
Un Momento Storico: Il Primo Uomo a Ricevere l'Editing di Base In Vivo
Per anni, questa tecnologia è stata oggetto di ricerche speranzose nei laboratori. Ma recentemente, abbiamo assistito a un momento storico che ha spostato la teoria nella realtà. La storia di K.J. Muldoon, un bambino nato con una grave e minacciosa malattia genetica rara, è stata fonte di incredibile ispirazione.
K.J. è stato diagnosticato con una carenza di carbamoyl-fosfato sintasi 1 (CPS1), un raro disturbo metabolico in cui il fegato non può processare l'ammoniaca, un sottoprodotto tossico della degradazione delle proteine.[21][22] Questa condizione può essere devastante, con un tasso di mortalità stimato del 50% nei primi mesi di vita.[23] Sappiamo della paura e dell'incertezza che accompagnano una diagnosi come questa.
Ma la specifica condizione di K.J. era causata da un errore di una sola lettera nel suo DNA—un candidato perfetto per l'editing di base. In un notevole sforzo, una terapia personalizzata è stata progettata appositamente per lui in soli sei mesi.[21] Ricevette un'infusione endovenosa di una LNP—la minuscola bolla di grasso—contenente le istruzioni mRNA per una "matita" editor di base progettata per correggere la sua esatta mutazione.[24][25]
I primi risultati sono stati fonte di profonda speranza:[23]
K.J. ha iniziato a tollerare più proteine nella sua dieta.
La dose dei farmaci di cui aveva bisogno per controllare i suoi livelli di ammoniaca è stata notevolmente ridotta.
Ha cominciato a raggiungere le sue tappe di sviluppo.
In particolare, è riuscito a combattere due virus infantili comuni senza entrare in una crisi di vita minacciosa, qualcosa che sarebbe stato quasi certo prima della terapia.
Dobbiamo percorrere questo cammino con sia speranza che realismo. Questa è stata una terapia per un bambino coraggioso, e dobbiamo ancora vedere quanto durerà la correzione.[23] Ma questa singola storia è una potente prova di concetto. Mostra che questa tecnologia è possibile e ha il potenziale di cambiare vite. Apre anche la porta a un futuro in cui le terapie potrebbero essere adattate al profilo genetico unico di un individuo.[24]
Questa non è solo una storia. La ricerca è attivamente in corso per altre condizioni. In modelli di laboratorio di Progeria, una malattia di invecchiamento prematuro, l'editing di base ha corretto l'errore genetico e ha esteso drasticamente la vita dei topi. Sono anche in corso studi clinici che utilizzano l'editing di base per condizioni come l'ipercolesterolemia (guidati da Verve Therapeutics) e la Deficienza di Alfa-1 Antitripsina (guidati da Beam Therapeutics).[26][27] Questa ondata di ricerca è guidata dalle esigenze di molte diverse comunità di pazienti, e ogni successo costruisce slancio per il successivo.
Andare Avanti Insieme: Il Cammino Davanti a Noi
L'alba dell'editing di base in vivo è incredibilmente emozionante, ma come comunità, sappiamo che i progressi devono essere compiuti in modo responsabile e con trasparenza. Ci sono ancora sfide significative da superare, ed è importante che ne parliamo apertamente.
La Sicurezza è Sempre al Primo Posto: La massima priorità è garantire che la "matita" modifichi solo la lettera del DNA prevista e nient'altro. Gli scienziati hanno sviluppato metodi rigorosi per controllare queste modifiche "off-target" e stanno continuamente lavorando per rendere gli strumenti ancora più precisi.[9][28]
Comprendere gli Effetti a Lungo Termine: Per qualsiasi terapia che apporta una modifica permanente, dobbiamo seguire i pazienti per un periodo molto lungo per garantire che i benefici siano durevoli e che non sorgano problemi imprevisti nel tempo.[10][29]
La Sfida dell'Accesso: Sappiamo che queste terapie avanzate sono attualmente incredibilmente complesse ed costose da realizzare, con alcune terapie geniche che costano oltre 2 milioni di dollari per trattamento.[30][31][32] Come comunità, è vitale che ci impegniamo per un futuro in cui questi trattamenti in grado di cambiare la vita siano accessibili a tutti coloro che ne hanno bisogno, indipendentemente dal luogo in cui vivono o dalle risorse di cui dispongono.[33] Questa è una conversazione che dobbiamo avere ora, all'inizio.
Il campo non rimane fermo. Gli scienziati stanno già sviluppando la prossima generazione di strumenti, come l'editing primario, un'altra innovazione del laboratorio del Dr. Liu che funziona come una funzione di "cerca e sostituisci" per il DNA e può correggere anche più tipi di errori genetici, comprese piccole inserzioni e cancellazioni.[34][35][36][37][38][39]
Mentre seguiamo questo nuovo confine della medicina, ci impegniamo a fornirti informazioni chiare e affidabili. Celebraremo i progressi e saremo onesti riguardo alle sfide. Continueremo a costruire una comunità in cui possiamo imparare, condividere e sostenerci a vicenda. Le tue intuizioni, le tue esperienze e la tua speranza sono ciò che alimenta questo progresso. In questo viaggio di scoperta, non sei solo.
Per una panoramica rapida, dai un'occhiata al nostro nuovo episodio di podcast, che esplora la storia e la scienza di questa terapia.
https://youtu.be/-aVHZciahbw
Fonti
[7] Menichiello, T. (2023, 27 settembre). Editing di Base e Editing Primario: Come Stanno Cambiando la Terapia Genica. Cell & Gene.
[30] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024). Prezzi Accessibili per i Trattamenti CRISPR: Un Imperativo Etico Pressante. CRISPR Journal.
[1] BioTechniques. (2017, 1 novembre). Le Matite Molecolari Riscrivono le Basi.
[40] Verve Therapeutics. (2025). VERVE-102. Recuperato da vervetx.com.
[31] Glick, B. (2023, 8 dicembre). Le nuove terapie geniche costose per le cellule falciformi pongono un test d'accesso. BioPharma Dive.
[33] CRISPR Therapeutics Canada. (2025, 28 gennaio). Il Vero Costo del Trattamento CRISPR: Cosa Necessitano i Pazienti Canadesi.
[8] Genethique. (2017, 2 novembre). ABE (editor di base di adenina): un "editor di basi" per completare il kit di strumenti CRISPR.
[21] Technology Networks. (2025, 27 giugno). Come è stata Creata la Prima Terapia Genica Personalizzata in 6 Mesi.
[2] Open Access Journals. (n.d.). Problemi Affrontati dai Medici nella Terapia Genica. Journal of Gene Therapy.
[41] Rare Disease Advisor. (2025, 15 aprile). Verve Therapeutics Riporta Risultati Promettenti per l'Editing Genico PCSK9 in HeFH.
[12] Biocompare. (2025, 2 gennaio). Superare le Sfide nelle Terapie Geniche Basate su AAV e rAAV.
[32] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024, 14 ottobre). Prezzi Accessibili per i Trattamenti CRISPR: Un Imperativo Etico Pressante. ResearchGate.
[10] Consensus. (n.d.). Quali sono le sfide nello sviluppo di terapie geniche per i disturbi genetici?.
[14] Form Bio. (n.d.). Il Ruolo di AAV nella Terapia Genica.
[22] Sanders, R. (2025, 15 maggio). Un neonato nato con una malattia mortale ora sta prosperando grazie a un trattamento CRISPR personalizzato sei mesi dopo la nascita. Berkeley News.
[5] Ma, Y., et al. (2023). Editing genoma preciso con editor di base. Journal of Genetics and Genomics.
[34] Howard Hughes Medical Institute. (2020, 12 giugno). L'Editing Genomico di Precisione Entra nell'Era Moderna.
[9] MedNexus. (2024). Terapia Genica Mirata: Promesse e Sfide nella Gestione delle Malattie. Journal of Bio-X Research.
[15] BioInnovatise. (2024, 9 dicembre). Risorse sulla Capacità di Imballaggio AAV.
[24] Ahn, N. (2025, 22 maggio). I ricercatori di Penn Med e CHOP trattano un neonato con la prima terapia di editing genico personalizzato al mondo. The Daily Pennsylvanian.
[28] Frontiers in Pediatrics. (2024). Avanzamenti e sfide nelle strategie di terapia genica per il cancro pediatrico: un aggiornamento completo.
[35] Rett Syndrome Research Trust. (n.d.). Editing Primario.
[29] Patsnap. (2025, 20 marzo). Quali sono le sfide etiche nella terapia genica?.
[26] Taylor, N.P. (2025, 5 maggio). 'Più sicuro' CRISPR: l'Editing di Base Avanza nella Clinica mentre Beam, Verve Progrediscono. BioSpace.
[36] Cross, R. (2019, 2 dicembre). Introduzione a CRISPR 3.0. C&EN Global Enterprise.
[23] Garcia de Jesus, E. (2025, 28 maggio). L'editing genico personalizzato ha salvato un bambino, ma il futuro della tecnologia è incerto. Science News.
[37] Synthego. (n.d.). Editing Primario come Strumento di Editing Genetico di Precisione.
[6] SCMP. (2023, 31 maggio). Scienziati cinesi sviluppano un nuovo strumento di editing genico che differisce nell'approccio da CRISPR-Cas9.
[27] DeFeudis, N. (2025, 11 marzo). Beam condivide dati clinici promettenti su un trattamento di editing genico per una malattia polmonare e epatica. Endpoints News.
[42] Wu, G. (2025, 24 marzo). Verve ottiene il via libera dalla FDA per espandere il trial di editing di base negli Stati Uniti. BioPharma Dive.
[3] Broad Institute. (2025, 5 aprile). David Liu riceve il Breakthrough Prize nelle Scienze della Vita.
[4] Howard Hughes Medical Institute. (2025, 5 aprile). David Liu riceve il Breakthrough Prize.
[43] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024). Prezzi Accessibili per i Trattamenti CRISPR: Un Imperativo Etico Pressante. Digital CSIC.
[13] High, K. A., & Roncarolo, M. G. (2019). Risposte immunitarie ai vettori AAV: superare le barriere a una terapia genica di successo. Molecular Therapy.
[38] O'Hanlon Cohrt, K. (2023, 4 dicembre). Spiegazione: Cos'è l'Editing Primario e a cosa serve?. CRISPR Medicine News.
[44] O'Hanlon Cohrt, K. (2025, 14 maggio). Gli Ultimi Aggiornamenti sui Trial Clinici da CRISPR Medicine News.
[16] GenScript. (2024, 15 ottobre). Nanoparticelle Lipidiche: Un Avanzamento nei Sistemi di Consegna CRISPR.
[39] Davies, H., & Auguste, A. (2023). Editing Genomico di Base e Primario nell'Oncologia di Precisione. Cancer Research.
[11] Revvity. (n.d.). Vettori AAV: sfide e soluzioni per la produzione di terapia genica.
[45] Verve Therapeutics. (2025, 14 maggio). Verve Therapeutics Annuncia Progresso nel Progetto e Riporta i Risultati Finanziari del Primo Trimestre del 2025.
[46] CRISPR Medicine News. (2025, 11 marzo). Beam Therapeutics Riporta Dati Clinici di Prova di Concetto per BEAM-302 nel Trial di Deficienza di Alfa-1 Antitripsina.
[47] Verve Therapeutics. (2025, 11 aprile). Verve Therapeutics Riceve la Designazione Fast Track dalla FDA per VERVE-102, un Farmaco di Editing di Base in Vivo che Mira a PCSK9.
[48] Beam Therapeutics. (2025, 10 marzo). Beam Therapeutics Annuncia Dati Iniziali Positivi per BEAM-302 nel Trial di Fase 1/2 in Deficienza di Alfa-1 Antitripsina (AATD), Dimostrando la Prima Correzione Clinica di una Mutazione Causante Malattia.
[25] Children's Hospital of Philadelphia. (2025, 15 maggio). Il Primo Paziente Trattato con Terapia di Editing Genico CRISPR Personalizzata presso il Children's Hospital di Philadelphia.
[17] ACS Publications. (2022, 20 maggio). Consegna Mediante Nanoparticelle Lipidiche di Componenti per l'Editing Genomico CRISPR/Cas9.
[18] PubMed Central (PMC). (n.d.). Nanoparticelle lipidiche: il cambiamento di gioco nell'editing genomico CRISPR-Cas9.
[49] Promega Connections. (2025, 28 maggio). L'Editing di Base Brillante: Il Breakthrough Prize di David Liu e il Suo Impatto.
[19] Nano Magazine. (2022, 19 dicembre). Consegna mediatata da nanoparticelle lipidiche di componenti CRISPR per editing genomico neurale.
[20] ACS Nanoscience Au. (2023, 30 marzo). Avanzamenti Recenti in Nanoparticelle Lipidiche Specifiche per Luogo per la Consegna di mRNA.









