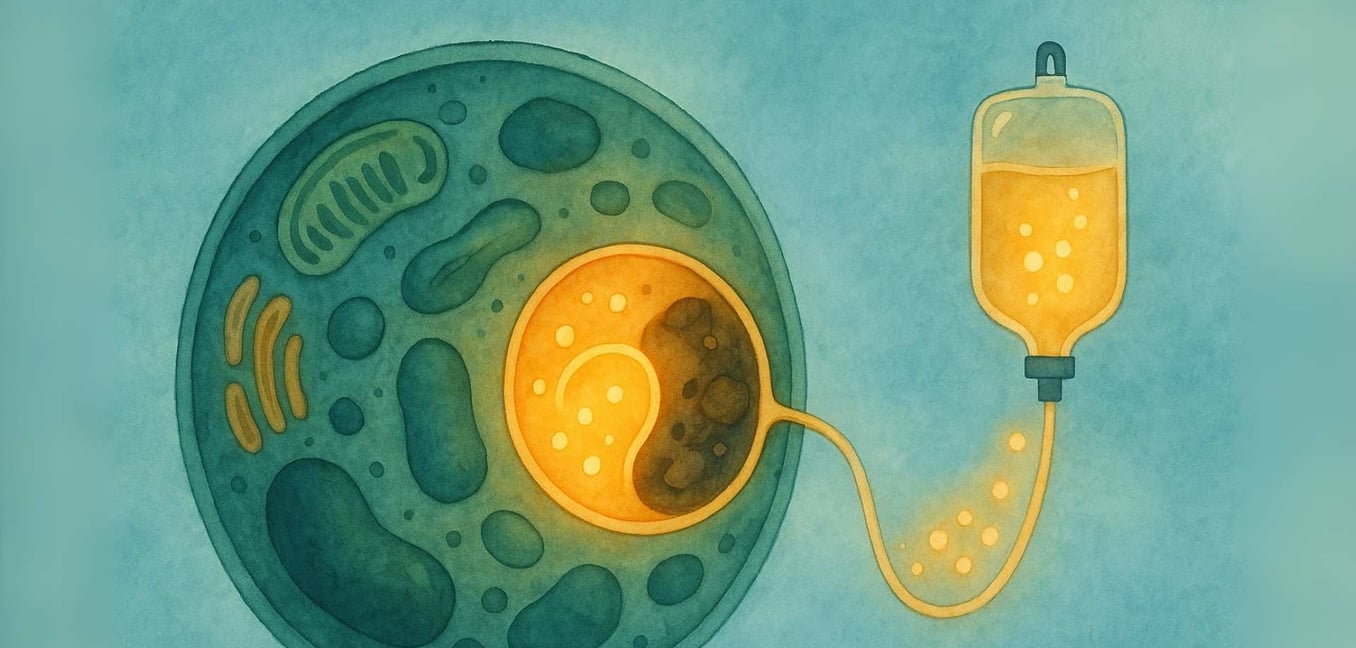
希少疾患との旅は、しばしば答えを求めることから始まります。リソソーム蓄積症(LSD)を持つ個人や家族が直面するその探求は、私たち自身の細胞の微視的な世界に踏み込むものです。これは、複雑な科学用語と深い不確実性に満ちた恐ろしい風景であることを私たちは知っています。私たちの目標は、この道を共に歩み、科学を明確で支援的な情報に分解することです。私たちは理解する力を信じており、明確さ、コミュニティ、そしてこの旅においてあなたが一人ではないという安心感を見つけることができる空間を提供することを約束します。
リソソーム蓄積症とは何ですか?
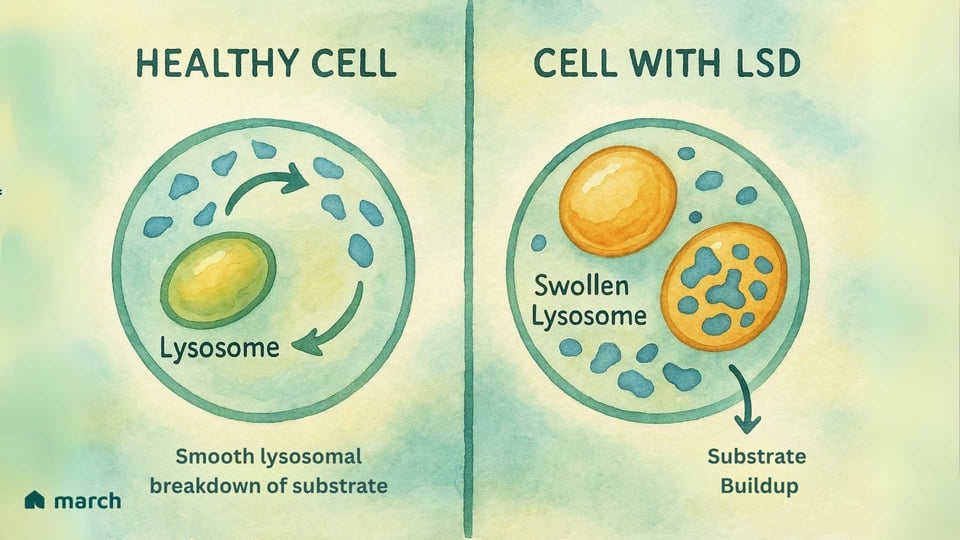
リソソーム蓄積症(LSD)は、細胞の重要な「リサイクルセンター」であるリソソームの中の課題です。LSDの物語は、1950年代にリソソームを発見したベルギーの科学者クリスチャン・ド・デューヴの画期的な業績から始まります。この業績により、彼は1974年のノーベル賞を受賞しました。彼は、これらの微小な小器官が細胞の消化システムであることを特定し、特殊なタンパク質である酵素で満たされています。健康な細胞では、リソソームはこれらの酵素で満たされており、脂肪や糖のような複雑な材料を細胞が再利用できるように、より単純な構成要素に分解します(プラット、2018年)。
LSDを持つ人の場合、特定の遺伝子変異により、これらの重要な酵素のうちの1つが欠如しているか、正常に機能していません。ほとんどのLSDは、常染色体劣性遺伝であり、子供が両親の両方から変異した遺伝子のコピーを受け継がなければならないことを意味します(ミークルら、1999年)。
都市のリサイクルシステムを想像してみてください。プラスチックを処理するチームが突然働かなくなると、プラスチックが積み重なり、都市全体に問題を引き起こします。これは、LSDの細胞内で何が起こるかに似ています。欠如している酵素が処理することになっていた特定の材料(基質と呼ばれる)が蓄積し始めます(プラット、2018年)。時間が経つにつれて、この堆積物はリソソームをこの蓄積された材料で肥大させ、細胞に損傷を与えます。この「細胞のゴミ危機」は、最終的に体のさまざまな臓器に影響を及ぼす広範な症状を引き起こす可能性があります(パレンティ、アンドリア&バラビオ、2015年)。
診断の旅:多様な症状のスペクトル
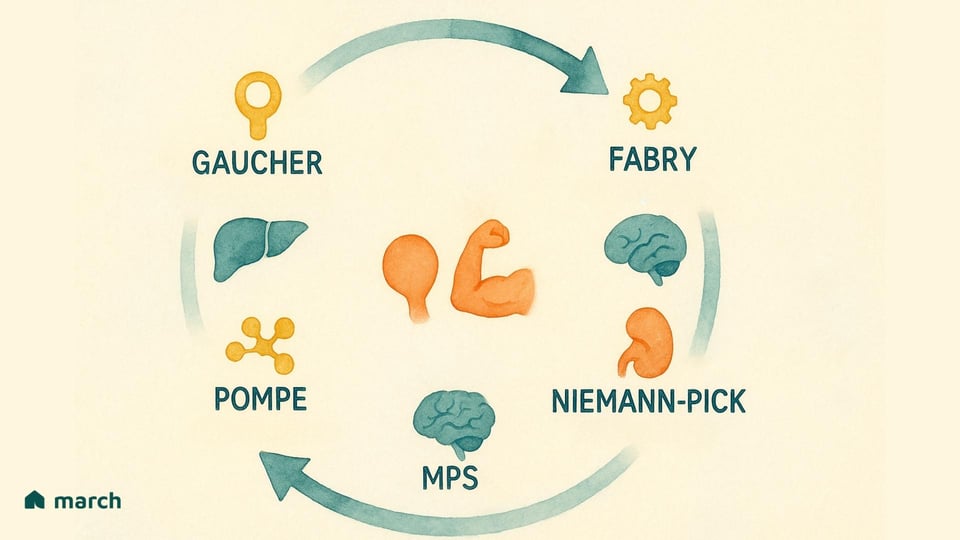
研究者たちは、現在、70種以上の異なるLSDを特定しています。すべてがリソソーム内の問題から生じていますが、それぞれが不足している特定の酵素とそれに伴う蓄積した基質によってさまざまな形で現れます。広く認識されているLSDには、以下のものが含まれます:
ゴーシェ病:酵素グルコセレブロシダーゼの欠乏によって引き起こされ、脂肪性物質グルコセレブロシドが蓄積します(グラボウスキー&ホプキン、2022年)。
ポンぺ病:複雑な糖であるグリコーゲンの蓄積を伴い、特に酸α-グルコシダーゼという酵素の欠如により筋肉細胞に影響を与えます(キシュナニら、2006年)。
ファブリー病:α-ガラクトシダーゼA酵素の欠乏から生じ、グロボトリアオシルセラミドと呼ばれる脂肪の一種が全身の細胞に蓄積します(ジェルマン、2010年)。
ムコ多糖症(MPS):異なる酵素が複雑な糖分子であるグリコサミノグリカン(GAG)を分解するのに必要で、これらの酵素が欠如している関連障害のグループ(ハーラー、ハンター、およびサンフィリッポ症候群を含む)(パレンティ、アンドリア&バラビオ、2015年)。
二種のニーマン・ピック病(A型、B型、C型)とテイ・サックス病:体の脂肪(リピッド)を代謝する能力に影響を及ぼし、深刻な神経障害を引き起こす他のよく知られたLSD(プラット、2018年)。
リソソームはほぼすべての細胞に存在するため、LSDの症状は非常に多様で進行的です。これらは脳や神経系、心臓、骨格系、肝臓、脾臓、肺、さらには目に影響を与える可能性があります(パレンティ、アンドリア&バラビオ、2015年)。私たちは、すべての旅が異なり、重篤度や発症年齢が同じ名前の疾患を持つ個人の間でさえ大きく異なる可能性があることを理解しています。
答えを見つける道を進む
多くの家族にとって、診断へ至る道は長く厳しいプロセスであり、しばしば「診断の旅」と呼ばれます(LSDコラボレーション、2015年)。初期の症状は微妙で非特異的であり、より一般的な子供の病気に似ていることがあり、フラストレーションの多い遅延や誤診を引き起こすことがあります(レイス、2002年)。この不確実性の期間がいかに困難であるか私たちは知っており、これはこれらの希少疾病に専門的でない人々の間での意識の深刻な課題を強調しています。一つの研究では、調査したプライマリケア医師の89%近くが、彼らの患者に対する潜在的な診断としてLSDを考慮したことがないことが明らかになっており、意識の深刻な課題を強調しています。
ついに診断を受け、困惑と痛みを伴う症状に名前が付けられたときの安堵感は計り知れません。ファブリー病を患う患者の一人であるP.は、彼女の症状は子供のころから始まりましたが、家族がかなり苦しんだ後、数十年後まで診断されることはありませんでした。
診断方法はますます洗練されてきています。通常は以下を含みます:
酵素アッセイ:特定のリソソーム酵素の活性レベルを測定する血液検査。著しく減少したか、欠如しているレベルは、LSDの重要な指標です(サン、2018年)。
遺伝子検査:酵素に責任を負う遺伝子内の特定の変異を確認し、これにより疾患の重度や治療選択肢を予測するのに役立つ場合があります(パレンティ、アンドリア&バラビオ、2015年)。
新生児スクリーニング(NBS):近年、ますます多くの地域でポンペ病、ゴーシェ病、ファブリー病、およびMPS Iのような治療可能なLSDを標準の新生児スクリーニングパネルに追加しています(バートン、2017年)。これにより、生後数日内にこれらの状態を特定し、重度で不可逆的な損傷が発生する前に、NBSは疾患の経過を変える最良の機会を提供します。
人間のコスト:単なる医療チャート以上のもの
私たちは、LSDの影響が身体的症状を超えて広がることを知っています。これらは慢性的、進行性で、しばしば衰弱させる状態であり、患者やその家族に深刻な医療的、感情的、社会的、経済的負担を強いるものです。日常的には慢性的な痛みや衰弱する疲労を管理しなければなりません。ゴーシェ病を患う男性のテッドは、普通の疲れとはまったく異なる動けなくなるような疲労について述べ、その結果、単純な作業さえも巨大なものに感じさせました。
感情の風景は複雑で、慢性的な病気を管理する際のストレス、未来への不安、そして健康が低下する際に伴う悲しみに満ちています。ポンペ病を持つソフィアの母親であるジェニーは、診断後の時期が恐ろしいものであったと語ります。「最も恐ろしい部分は...確定的な答えがなく、何が起こるか、いつ起こるかを知らないことでした。」これは家族のダイナミクスや生活の選択を再形成する旅であり、私たちはこれらの深く個人的な経験が共有され、検証され、理解されるコミュニティを提供することに尽力しています。
アイデアが現実になる
数十年の間、これらの状態に対する治療選択肢は心が痛むほど限られていました。しかし、リソソームの発見者クリスチャン・ド・デューヴが1964年に最初に概念化した革命的なアイデアがすべてを変えました(ベック、2018年)。そのコンセプトは単純ですが深いものでした:外部から欠如した酵素を置き換えることができるとしたらどうだろう?この洞察は、酵素補充療法(ERT)の基盤を築きました(ド・デューヴ、1964年)。
概念からクリニックへ進む旅は、先駆的な科学的献身のものでした。1970年代、重要な実験により、ラボ皿の中で欠如した細胞が健康な細胞が分泌した酵素を吸収できることが示されました。これは「クロスコレクション」と呼ばれています(フラタントーニ、ホール、&ノイフェルト、1968年)。これにより基本原理が機能することが確認されました。さらなる研究では、酵素をリソソームに導く細胞の「住所ラベル」が特定されました。これはマンノース-6-リン酸(M6P)と呼ばれる糖分子で、細胞表面の特定のM6P受容体に結合します(コーンフェルド、1986年)。
真の臨床的突破口は、ロスコー・ブレイディ博士と彼のチームによって、国立衛生研究所で推進されました(ベック、2018年)。ゴーシェ病に焦点を当て、彼らは必要な酵素(グルコセレブロシダーゼ)を人間の胎盤から精製し、適切な細胞をターゲットにするために生化学的に修正しました(ブレイディら、1974年)。臨床試験は驚くべき成功を収め、その結果、1991年に初のERTであるCeredase™のFDA承認が得られました(ベック、2018年)。これは新たな時代を告げるものでした。
今日では、再組換えDNA技術のおかげで、ERTはもはや人間の組織から供給されません。これらは安全で一貫して、厳重な研究所環境で大量生産されるようになりました。この大きな進歩により、安全性と供給が改善されました(プラット、2018年)。
酵素補充療法(ERT)の仕組み
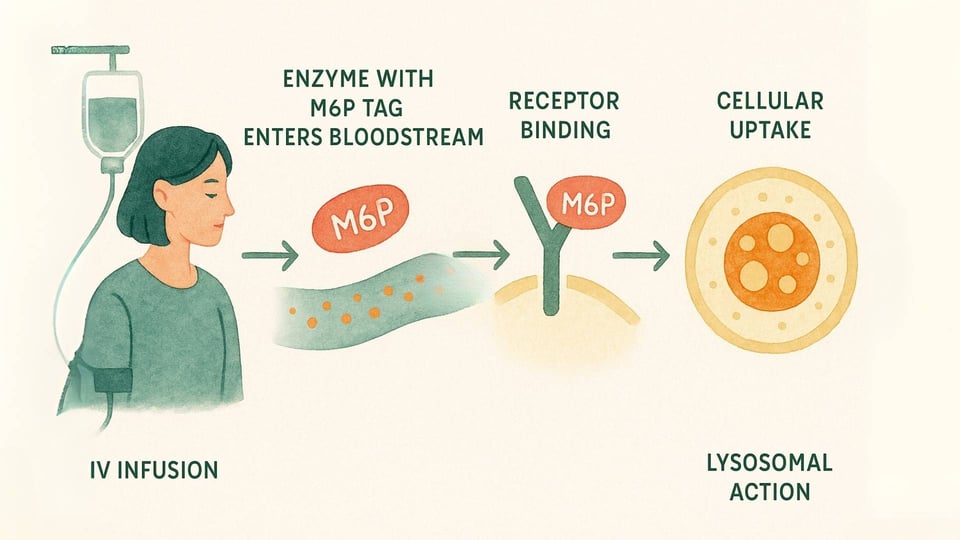
ERTは、欠如した酵素の機能を持つバージョンを、最も必要とする細胞に直接送達するために設計された医療治療です。以下にプロセスを詳しく見ていきましょう:
注入:この治療は通常、数時間にわたってIV(静脈内)でゆっくりと注入され、通常1〜2週間ごとに行われます(ベック、2018年)。
配送システム:これらの酵素は、体の細胞が認識できる特別なM6P「住所ラベル」を用いて設計されています。これにより、酵素は細胞表面のM6P受容体に結合でき、特定の鍵が特定のロックにはまるような作用を果たします(コーンフェルド、1986年)。
細胞作用:細胞が酵素を認識し、結合すると(エンドサイトーシスと呼ばれるプロセスによって)、酵素を内部に迎え入れ、リソソームに直接連れて行きます。そこで、置き換えられた酵素は蓄積された材料を分解し、細胞内での健康的なバランスを取り戻す手助けをすることができます(コーンフェルド、1986年)。
治療の旅:希望と誠実な期待
ERTは治療法であり、治療法ではありません(プラット、2018年)。これは基礎的な遺伝的欠陥を修正せず、患者やその家族にとっての重要な生活の一環として、定期的な注入を生涯にわたって続ける必要があります(ベック、2018年)。
さらに、ERTにはいくつかの重要な課題があります:
血液脳関門(BBB):これはおそらく最大の課題です。BBBは、大きな分子(ERT酵素を含む)が脳に入るのを防ぐ保護シールドです。推定でLSDの3分の2が神経学的症状を持つため、標準的なERTは、体のその他の部分を助ける一方で、認知機能の低下や他の中枢神経系の問題にたいしてはしばしば効果がないのです。
免疫応答:注入された酵素がタンパク質であるため、体は時にはこれを「外国」と見なし、抗薬物抗体(ADA)を生成することがあります。これらの抗体は治療法の効果を減少させたり、発熱、発疹、またはより重篤なアレルギー反応のような注入関連反応(IAR)を引き起こすことがあります。
「聖域」の組織への届け:脳を越えて、大きな酵素分子が到達するのが難しい特定の組織があります。これには、密な骨、血液供給のない軟骨、心臓弁が含まれるため、治療にもかかわらず骨格問題や弁性心疾患が進行する可能性があります。
治療の武器を拡大する
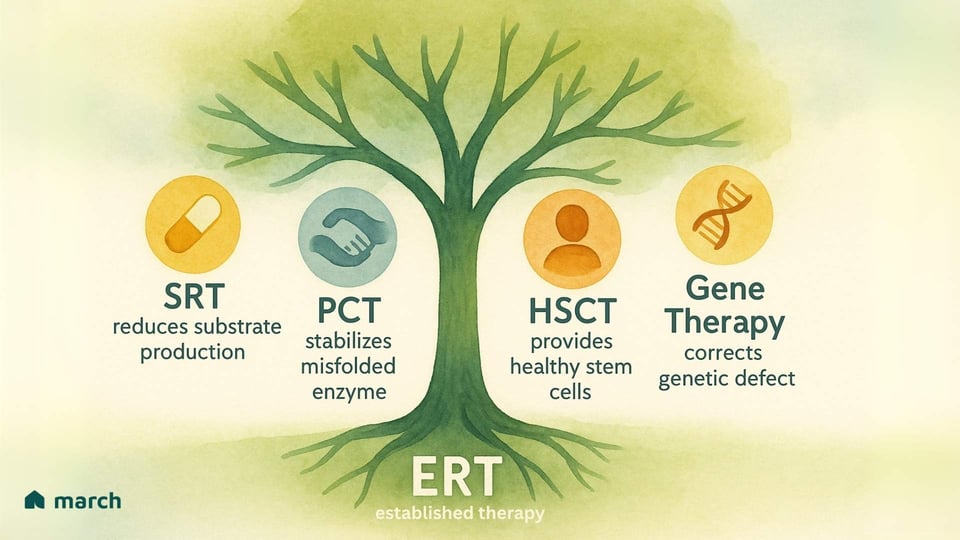
ERTの限界は、研究者や私たちのコミュニティに新しくより良い治療法の追求を促しています。治療の未来は、これらの状態に対して多面的な攻撃を重視し、いくつかのエキサイティングな戦略が現れています:
基質削減療法(SRT):酵素を置き換えるのではなく、このアプローチは、基質を最初に生成するのに関与する酵素を抑制する経口薬を使用します。これにより、問題のあるリソソームの「負荷を軽減」します。ゴーシェ病1型に使用される承認薬には、ミグルスタットやエリグルスタットがあります。
薬理学的シャペロン療法(PCT):適切な機能を持つが誤って折りたたまれている酵素を生産する患者に対して、これらの小さな経口薬は「足場」として機能します。彼らは不安定な酵素に結合し、酵素が正しく折りたたまれ、細胞の品質管理を通過し、リソソームに到達できるようにします。ミガラスタットは特定の「好適」変異を持つファブリー患者のための承認されたシャペロンです。
造血幹細胞移植(HSCT):中枢神経系に関与するいくつかの重度のLSD(MPS I(ハーラー症候群)など)に対して、健康なドナーからのHSCT(または骨髄移植)が選択肢となることがあります。アイデアは、ドナー由来の細胞が脳に移動し、欠如した酵素の局所的かつ継続的な供給源を提供することです。ただし、これは非常に高リスクの手続きであり、重大な合併症を伴う可能性があります。
遺伝子治療:これは最もエキサイティングで潜在的に変革的な最前線の一つです。目的は、患者自身の細胞に正しい遺伝子の機能的コピーを提供し、彼ら自身が酵素を生産できるようにすることです。エンジニアリングされたウイルスベクターや他の供給システムを使用して、研究者たちは疾患の根本的な原因を修正する長期的かつ一回限りの治療を提供する方法を探求しています。ポンペ病、ファブリー病、いくつかのMPS障害に対する臨床試験が進行中であり、強力な希望の源を提供しています。
共に前進する
リソソームの基本的な発見からERTの開発、遺伝子ベースの医療の夜明けに至るまでの道のりは、科学的探求と人間の回復力の力を証明しています。私たちは、この前進を共に続けることに尽力しています。私たちは常に信頼できる明確な情報を提供し、支援的で思いやりのあるコミュニティを育み、実際の希望をもたらす研究を推進するよう努めます。
酵素補充療法の簡潔でありながら洞察に満ちた概要については、新しいポッドキャストエピソードをお聴きいただくことをお勧めします。この複雑なトピックを容易に理解できるセグメントに分解するように設計されています。
https://youtu.be/T91yim2x8ac?si=Rla7FYMAWxCLUVc8
参考文献
ノーベル賞アウトリーチ AB. (2024). 1974年の生理学または医学におけるノーベル賞。NobelPrize.org.
ド・デューヴ, C. (2013). クリスチャン・ド・デューヴ:遠心分離機を使って新しい小器官を発見した細胞の探検者。国立科学アカデミー紀要, 110(31), 12559-12561。
ロックフェラー大学. (n.d.).「遠心分離機で細胞を探検する」:リソソームの発見。病院の百年記念。
MSDマニュアルプロフェッショナル版. (n.d.). リソソーム蓄積障害の概要。
コロンビア大学アーヴィング医療センター. (n.d.). 小児リソソーム蓄積障害。
クリーブランドクリニック. (2022年6月27日). リソソーム蓄積病&障害。
クリーブランドクリニック. (2022年6月27日). リソソーム蓄積病&障害。
バイオサイエンス研究所. (n.d.). リソソーム蓄積病(LSD)。
ヴァン・デア・メイデン, J. C., 他. (2010). 「グーグル博士」がリソソーム蓄積障害における診断の旅を終わらせる。小児病アーカイブ, 95(8), 642-644。
メディコバー遺伝学. (2025年2月26日). 診断の旅:希少疾病に対する答えを探す。
南アフリカの希少疾病. (2023年2月28日). リソソーム蓄積症診断と治療の課題に取り組む。
グリーンウッド遺伝子センター. (2024年8月14日). リソソーム蓄積障害:ゴーシェ病とファブリー病。
ウィキペディア. (n.d.). 酵素補充療法。
ベック, M. (2018). 酵素補充療法とその先―故ロスコー・O・ブレイディ博士を偲んで、M.D. (1923-2016)。遺伝性代謝疾患ジャーナル, 41(1), 3-13。
パーク, J. J., & リー, K. (2022). リソソームターゲティングのためのマンノース-6-リン酸糖:酵素補充療法からリソソームターゲティングのキメラまでのさまざまな応用。動物細胞とシステム, 26(3), 84-91。
米国食品医薬品局 (FDA). (1991). 希少薬品指定および承認の検索:Ceredase。
全米ゴーシェ病財団. (n.d.). ERTのFDA承認25周年。
ベグリー, D. J. (2015). リソソーム蓄積病患者に希望をもたらすための血液-脳障壁輸送の修正。脳血流代謝ジャーナル, 35(1), 3-5。
パードリッジ, W. M. (2015). 治療的リソソーム酵素の血液-脳関門標的。リソソーム蓄積障害, 327-343。
アフラキ, E., 他. (2018). 酵素補充療法:最良の選択肢は何か?。現在の製薬設計, 24(11), 1238-1250。
ジュリアニ, R., 他. (2018). ムコ多糖症に対する酵素補充療法:新しい展開と臨床結果。オーファンドラッグに関する専門意見, 6(4), 277-287。
ゴーシェ病ニュース. (n.d.). ゴーシェ病に対する基質削減療法。
全米ゴーシェ病財団. (n.d.). 基質削減療法。
シン, S-H., 他. (2007). 薬理学的シャペロンがトラフィッキング無能変異によって引き起こされるファブリー病のリソソーム蓄積を修正します。アメリカ生理学ジャーナル-細胞生理学, 292(5), C1879-C1887。
ファブリー病ニュース. (2024年4月19日). ファブリー病のシャペロン療法。
全米MPS協会. (n.d.). HSCT。
ラ・ファウチ, G., & A.H. シュクマン. (2016). リソソーム蓄積障害に対する遺伝子治療:最近の進展と限界。先天的代謝異常とスクリーニングのジャーナル, 4, 1-7。
イイモリ, T., 他. (2023). リソソーム蓄積障害に対する遺伝子療法:現在の臨床試験の見通し。遺伝学のフロンティア, 14, 1064924。
プラット, F. M., ダッツォ, A., デビッドソン, B. L., ノイフェルト, E. F., & ティフ, C. J. (2018). リソソーム蓄積病。自然レビュー疾病プライマー, 4(1), 27。