对于我们社区中许多家庭来说,患有罕见遗传疾病的旅程从身体“说明书”的一处小小错误开始——我们的 DNA。我们知道,理解这些疾病背后的科学可以成为感受到 empowerment 的第一步。几十年来,治疗方法一直侧重于管理症状,而不是解决问题的根源。但今天,我们希望与您一起走过一个代表希望新篇章的发展,这是一段令人难以置信的科学进步故事,直击这些疾病的核心。
我们听说了一种名为 活体基础编辑 的突破性技术。我们知道这些科学术语可能会让人感到畏惧,因此这里的目标是一起解读。这是一个关于从对我们 DNA 进行重大改变到进行极其精确的改变的故事。它讲述了一种新的“分子铅笔”,提供了一种更温和、更有针对性的方法来纠正原始的遗传错误。[1]
这是对科学、希望以及这一新前沿的现实挑战的深入探讨。我们相信通过理解它,我们可以进行更明智的对话,提出更好的问题,共同向前迈进,更清楚地了解未来可能会发生的事情。
从分子剪刀到遗传铅笔:基因编辑的演变
为了解释基础编辑的突破,首先需要回顾一下它之前的技术: CRISPR-Cas9。你可能听说过 CRISPR 被描述为“分子剪刀。”[1] 这是一个革命性的发现,赋予科学家在我们 DNA 中寻找特定位置并进行切割的能力。这是一个重要的飞跃,使研究人员能够“关闭”有缺陷的基因。这项技术是首个获得批准的基于 CRISPR 的镰状细胞病治疗的基础, Casgevy,在这种情况下,细胞被取出体外,利用这些剪刀进行编辑,然后再返回给患者。
尽管功能强大,在我们的 DNA 中进行双链切割的想法总是伴随着挑战。细胞对于此类切割的自然修复过程可能有点不可预测,有时会导致意外的变化。[2] 我们知道,要广泛使用任何治疗方法,尤其是在体内,安全性是绝对的首要任务。
这就是 基础编辑 的出现,代表着这一进步旅程的下一步。基础编辑由包括由 大卫·刘博士 领导的哈佛大学和布罗德研究所的研究人员开发,基础编辑被设计成更像是一支“分子铅笔”。[3][4] 它的初衷是在不进行破坏性切割的情况下,在 DNA 代码的某个字母上进行精准改变。[5][6]
我们可以这样理解它的工作原理:
导向分子:一种称为引导 RNA(gRNA)的分子像 GPS 一样,引导基础编辑器前往组成我们 DNA 的数十亿个字母中的确切特定“错误”。[1]
锚:基础编辑器使用一种去激活的 CRISPR 蛋白(通常称为 nickase 或“无效的” Cas9)作为锚。它在正确的位置上固定在 DNA 上,但这是一个关键的不同点——它不会进行双链切割。[5][7]
铅笔:与这个锚结合的是一种特殊的酶(去氨基酶),它充当铅笔。它进行化学反应,有效地擦除不正确的 DNA 字母,并用正确的字母替代。[7][8]
这种方法的美在于它的精确性和温和性。通过避免切割,它绕过了许多与原始“分子剪刀”相关的担忧,提供了一种潜在更安全的方法来纠正导致许多罕见疾病的根本遗传错误。[1][9]
传递挑战:将铅笔送到正确的页面
拥有一种了不起的“基因铅笔”是一回事,但将其送到身体深处的正确细胞是基因疗法中最大的一项挑战之一。[2][10] 这就是拼图的“体内”部分——在活体内进行编辑。对于许多影响器官如肝脏、大脑或肌肉的病症,这是基因疗法唯一能正常工作的方式。
科学家们在这个传递问题上不懈努力,出现了两种主要的方法,成为了领军者。把它们想象成两种不同类型的微观传递卡车:
病毒载体(如 AAVs):这些基本上是被掏空并重新设计的病毒壳,以免引起疾病。相反,它们被填充着制作基础编辑器的遗传指令。
优势: 病毒天然非常擅长进入我们的细胞,不同类型的 腺相关病毒 (AAVs) 以往有针对特定组织如肌肉或眼睛的已知能力。[11] 它们在基因疗法研究中有着悠久的历史。
挑战:我们知道我们的身体是设计来抵抗病毒的。这意味着许多人已经具备的免疫力可能在载体完成它的任务之前阻止它。[12][13] 这种免疫反应也导致了难以进行第二次剂量的给药。[12] 此外,AAVs 的“货舱空间”有限,大约为 4.7 千碱基,对于基础编辑设备来说,这可能太紧了。[14][15]
脂质纳米粒子 (LNPs): 你可能从 mRNA COVID-19 疫苗中听说过这些。LNPs 是微小的、工程化的脂肪气泡,可以携带基础编辑器的遗传指令(以 mRNA 形式)。[16][17]
优势: LNPs 具有更大的货舱空间,且不太可能引发强烈的免疫反应,这意味着重新给药可能是可行的。[2][16] 一个巨大的安全优势是它们提供的是临时指令。细胞制造“铅笔”,然后执行其功能,然后指令和铅笔会自然清除。这一短暂的活动窗口降低了某些不必要编辑的风险。[18]
挑战: 目前,LNPs 通常通过静脉注射给药,大多都被肝脏自然吸收。[19][20] 虽然这对于治疗肝脏疾病是完美的,但研究人员正在努力开发新的 LNPs,能够导向身体内部的其他组织。[16]
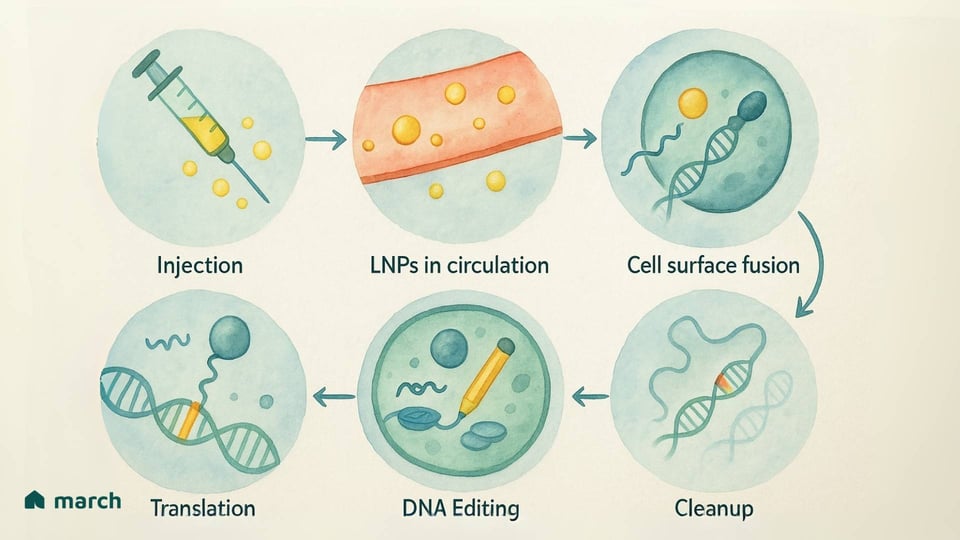
这些传递系统的进展与编辑工具本身同样重要。让这些“卡车”变得更加安全和有针对性,每一步都是我们社区的进步。
一个里程碑时刻:第一个接受体内基础编辑的人类
多年来,这项技术一直是实验室中充满希望的研究课题。但最近,我们见证了一个将其理论转变为现实的里程碑时刻。 K.J. Muldoon的故事,一名出生时患有严重且危及生命的罕见遗传疾病的婴儿,成为了巨大的灵感来源。
K.J. 被诊断为氨甲酰磷酸合成酶 1(CPS1)缺乏症,这是一种罕见的代谢紊乱,导致肝脏无法处理氨,这是一种分解蛋白质的有毒副产品。[21][22] 这种情况可能是毁灭性的,早期婴儿的死亡率约为 50%。[23] 我们了解这种诊断所带来的恐惧和不确定性。
但是 K.J. 的特定情况是由于他 DNA 中的单个字母错误引起的——一个基础编辑的完美候选者。在令人瞩目的努力下,一种 个性化疗法专门为他设计,仅用了六个月的时间。[21] 他接受了含有针对其确切突变的基础编辑器“铅笔”的 mRNA 指令的 LNP(微小脂肪气泡)静脉注射。[24][25]
初步结果成为深刻希望的源泉:[23]
K.J. 开始能够在饮食中耐受更多的蛋白质。
他控制氨水平所需的药物剂量显著减少。
他开始达到他的发育里程碑。
最重要的是,他能够抵御两种常见的儿童病毒,而没有陷入危及生命的危机,这在治疗前几乎是确定的。
我们必须以希望和现实主义共同走过这条道路。这是一项针对一个勇敢孩子的疗法,我们仍需观察修正可以持续多长时间。[23] 但是这个单一的故事是一个强有力的概念证明。它表明这项技术是可能的,并有潜力改变生活。它还为未来打开了一扇大门,在那里,疗法可以根据个人独特的遗传构成量身定制。[24]
这不仅仅是一个故事。对其他疾病的研究也在积极进行中。在早老症的实验室模型中,基础编辑已纠正了遗传错误并显著延长了小鼠的寿命。针对高胆固醇(由 Verve Therapeutics)和 α-1抗胰蛋白酶缺乏症(由 Beam Therapeutics)等疾病的基础编辑临床试验也在进行中。[26][27] 这一波研究正是受到了许多不同患者群体的需求驱动,每一次成功都为下一次的发展奠定了势头。
共同前进:未来的旅程
体内基础编辑的黎明令人无比兴奋,但作为一个社区,我们知道这一进程必须以负责任和透明的方式推进。还有许多重要挑战需要克服,重要的是我们要开放地讨论它们。
安全始终是第一位的:首要任务是确保“铅笔”仅编辑意图中的 DNA 字母而不涉及其他字母。科学家们开发了严格的方法来检查这些“脱靶”编辑,并不断努力让工具更加精准。[9][28]
理解长期效果:对于任何做出永久性改变的疗法,我们需要长期跟踪患者,以确保益处是持久的,并且在将来不会出现意想不到的问题。[10][29]
获取挑战:我们知道这些先进疗法目前非常复杂且昂贵,某些基因疗法每次花费超过 200 万美元。[30][31][32] 作为一个社区,我们必须倡导一个未来,在这里,这些改变生活的治疗能够对每一个需要的人开放,无论他们身在何处或具有什么资源。[33] 这是我们现在必须进行的对话,在这个开始时刻。
这个领域并没有停滞。科学家们已经在开发下一代工具,例如基本编辑,这是刘博士实验室的另一个创新,它像“查找和替换”功能一样工作,可以修复更多类型的遗传错误,包括小的插入和缺失。[34][35][36][37][38][39]
随着我们观察这一新医学前沿的展开,我们致力于为您提供清晰、值得信赖的信息。我们将庆祝突破,并坦诚面对挑战。我们将继续建立一个社区,在这里我们可以学习、分享和相互支持。您的见解、您的经历和您的希望是推动这一前行的动力。在这段探索之旅中,您并不孤单。
快速概述,请查看我们新播客的集,该集中探讨了该疗法的历史和科学。
来源
[7] Menichiello, T. (2023年9月27日)。基础编辑和基本编辑:这些技术如何改变基因疗法。细胞与基因。
[30] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024)。CRISPR治疗的可负担定价是紧迫的伦理权利。CRISPR杂志。
[1] BioTechniques. (2017年11月1日)。分子铅笔重写基础。
[40] Verve Therapeutics. (2025)。VERVE-102。检索自 vervetx.com。
[33] CRISPR Therapeutics Canada. (2025年1月28日)。CRISPR治疗的真实成本:加拿大患者需要知道的事情。
[8] Genethique. (2017年11月2日)。ABE(腺嘌呤基础编辑):完成CRISPR工具包的“基础编辑器”。
[21] Technology Networks. (2025年6月27日)。世界首个定制基因疗法如何在六个月内创建。
[2] Open Access Journals. (无日期)。基因疗法中医生面临的问题。基因疗法杂志。
[41] Rare Disease Advisor. (2025年4月15日)。Verve Therapeutics报告PCSK9基因编辑的良好结果。
[12] Biocompare. (2025年1月2日)。克服AAV和rAAV基因疗法的挑战。
[32] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024年10月14日)。CRISPR治疗的可负担定价是紧迫的伦理权利。ResearchGate。
[10] Consensus. (无日期)。为遗传疾病开发基因疗法的挑战是什么?
[14] Form Bio. (无日期)。AAV在基因疗法中的作用。
[22] Sanders, R. (2025年5月15日)。一名婴儿出生于致命疾病,六个月后得益于定制的CRISPR治疗,现在蓬勃发展。伯克利新闻。
[5] Ma, Y., 等. (2023年)。利用基础编辑进行精准基因组编辑。遗传学与基因组学杂志。
[34] Howard Hughes Medical Institute. (2020年6月12日)。精准基因组编辑进入现代时代。
[9] MedNexus. (2024)。靶向基因疗法:疾病管理中的承诺与挑战。Bio-X研究杂志。
[15] BioInnovatise. (2024年12月9日)。AAV包装能力资源。
[24] Ahn, N. (2025年5月22日)。宾州医科大学、儿童医院的研究人员治疗了全球首例个性化基因编辑疗法患者。宾夕法尼亚日报。
[28] Frontiers in Pediatrics. (2024)。儿童癌症基因治疗策略的进展与挑战:综合更新。
[35] Rett Syndrome Research Trust. (无日期)。基础编辑。
[29] Patsnap. (2025年3月20日)。基因疗法的伦理挑战是什么?
[26] Taylor, N.P. (2025年5月5日)。更安全的CRISPR:基础编辑在临床中的突破,Beam和Verve取得进展。BioSpace。
[36] Cross, R. (2019年12月2日)。介绍CRISPR 3.0。C&EN全球企业。
[23] Garcia de Jesus, E. (2025年5月28日)。个性化基因编辑拯救了一名婴儿,但该技术的未来仍然不确定。科学新闻。
[37] Synthego. (无日期)。基础编辑作为精准基因编辑工具。
[6] SCMP. (2023年5月31日)。中国科学家开发出一种新基因编辑工具,其方法与CRISPR-Cas9不同。
[27] DeFeudis, N. (2025年3月11日)。Beam分享了针对肺部和肝脏疾病的基因编辑治疗的首个临床数据,展现了首个临床遗传纠正的成果。Endpoints News。
[42] Wu, G. (2025年3月24日)。Verve获得FDA批准扩大其基础编辑试验进入美国。BioPharma Dive。
[3] Broad Institute. (2025年4月5日)。大卫·刘获颁突破奖生命科学奖。
[4] Howard Hughes Medical Institute. (2025年4月5日)。大卫·刘获颁突破奖。
[43] Rueda, J., de Miguel Beriain, I., & Montoliu, L. (2024)。CRISPR治疗的可负担定价是紧迫的伦理权利。数字 CSIC。
[13] High, K. A., & Roncarolo, M. G. (2019)。对AAV载体的免疫反应:克服成功基因治疗的障碍。分子治疗。
[38] O'Hanlon Cohrt, K. (2023年12月4日)。解释:什么是基础编辑,它的用途是什么?CRISPR医学新闻。
[44] O'Hanlon Cohrt, K. (2025年5月14日)。CRISPR医学新闻的最新临床试验更新。
[16] GenScript. (2024年10月15日)。脂质纳米粒子:CRISPR传递系统的突破。
[39] Davies, H., & Auguste, A. (2023)。基础和基础基因组编辑在精准癌症治疗中的应用。癌症研究。
[11] Revvity. (无日期)。AAV载体:基因治疗制造中的挑战与解决方案。
[45] Verve Therapeutics. (2025年5月14日)。Verve Therapeutics宣布管道进展,并报告2025年第一季度财务结果。
[46] CRISPR医学新闻。 (2025年3月11日)。Beam Therapeutics报告对α-1抗胰蛋白酶缺乏症试验中BEAM-302的临床证明数据。
[47] Verve Therapeutics。 (2025年4月11日)。Verve Therapeutics获得美国FDA快速通道认证,针对PCSK9的VERVE-102。这是一种体内基础编辑药物。
[48] Beam Therapeutics。 (2025年3月10日)。Beam Therapeutics宣布关于BEAM-302的初步积极数据,在α-1抗胰蛋白酶缺乏症的第1/2期临床试验中,首次实现具有病因突变的临床遗传修正。
[25] 费城儿童医院。 (2025年5月15日)。世界首例通过个性化CRISPR基因编辑治疗的患者在费城儿童医院治疗。
[17] ACS Publications. (2022年5月20日)。基于脂质纳米粒子的CRISPR/Cas9基因组编辑成分的传递。
[18] PubMed Central (PMC)。 (无日期)。脂质纳米粒子:CRISPR-Cas9基因组编辑的游戏规则改变者。
[49] Promega Connections. (2025年5月28日)。基础编辑的辉煌:大卫·刘的突破奖及其影响。
[19] 纳米杂志。 (2022年12月19日)。脂质纳米粒子介导的CRISPR成分在神经元基因组编辑中的应用。
[20] ACS纳米科学Au。 (2023年3月30日)。近年来用于mRNA传递的特定脂质纳米粒子的最新进展。
[6]









