在我们社区的许多人中,与 滑膜肉瘤 的旅程通常不是从清晰开始的,而是通过一个令人沮丧且通常漫长的寻求答案的过程开始的。[1] 我们知道这条道路通常充满不确定性。因为它是一种罕见的癌症,主要影响青少年和年轻成年人(AYA人群),其初始症状——通常是缓慢生长的无痛肿块——常常被误认为是更常见的情况,比如运动损伤或囊肿。[2][4] 这可能导致一场持续长达两年的“诊断漫游”,这对于一种侵袭性癌症来说是一个关键的延误。[1]
这个诊断落在年轻人身上,正值他们生活中的关键时刻,干扰教育、职业和家庭规划。数十年来,针对晚期或转移性疾病的前进道路一直令人畏惧。标准化疗方案虽然重要,却提供了有限的长期成功。[3] 对于被诊断为转移性滑膜肉瘤的成人来说,五年总体生存率悲惨地只有10%。[3] 二线治疗方法如 帕唑帕尼 或 噻替派 虽然提供了选择,但通常只提供适度的好处,中位数总体生存期徘徊在10个月左右。[5] 对真正突破的需求一直存在,感受到的需求非常深刻。
但今天,我们想和您一起走过一段科学进步的故事,这带来了新的希望。这是一种不仅仅与癌症作斗争的治疗,还教会患者自己的身体如何去对抗。我们所谈论的是一种名为阿法米特基因自体细胞的里程碑新疗法,或称 Tecelra。[11]
这将深入探讨科学、希望以及这一新前沿的现实挑战。我们相信,通过了解它,我们可以与我们的护理团队进行更有见地的对话,提出更好的问题,并共同前进,清晰地认识未来可能的前景。这种治疗不仅仅是一种新药;它是一个新篇章,触及滑膜肉瘤独特性的核心。
科学:一个锁、一把钥匙和一个训练有素的士兵
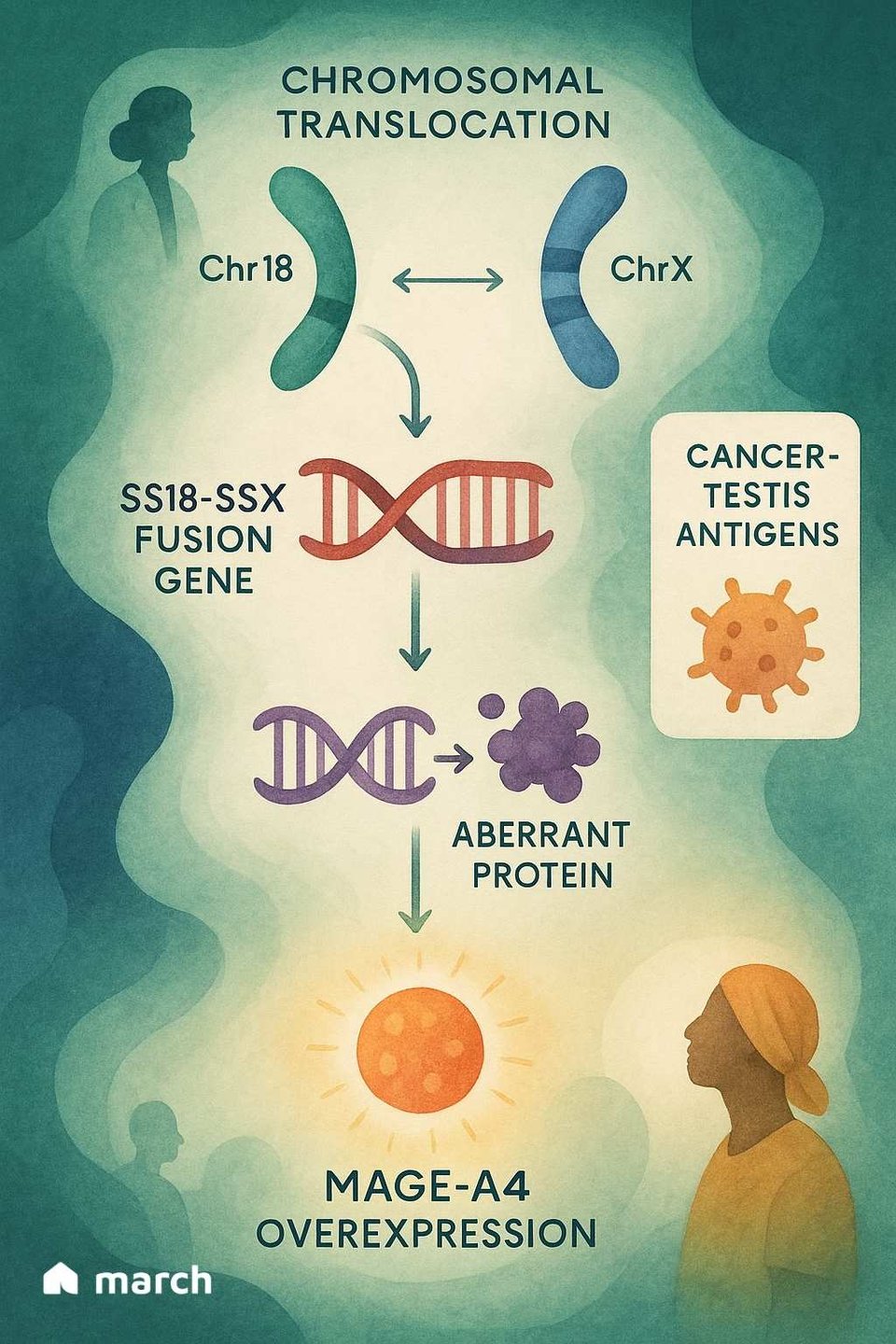
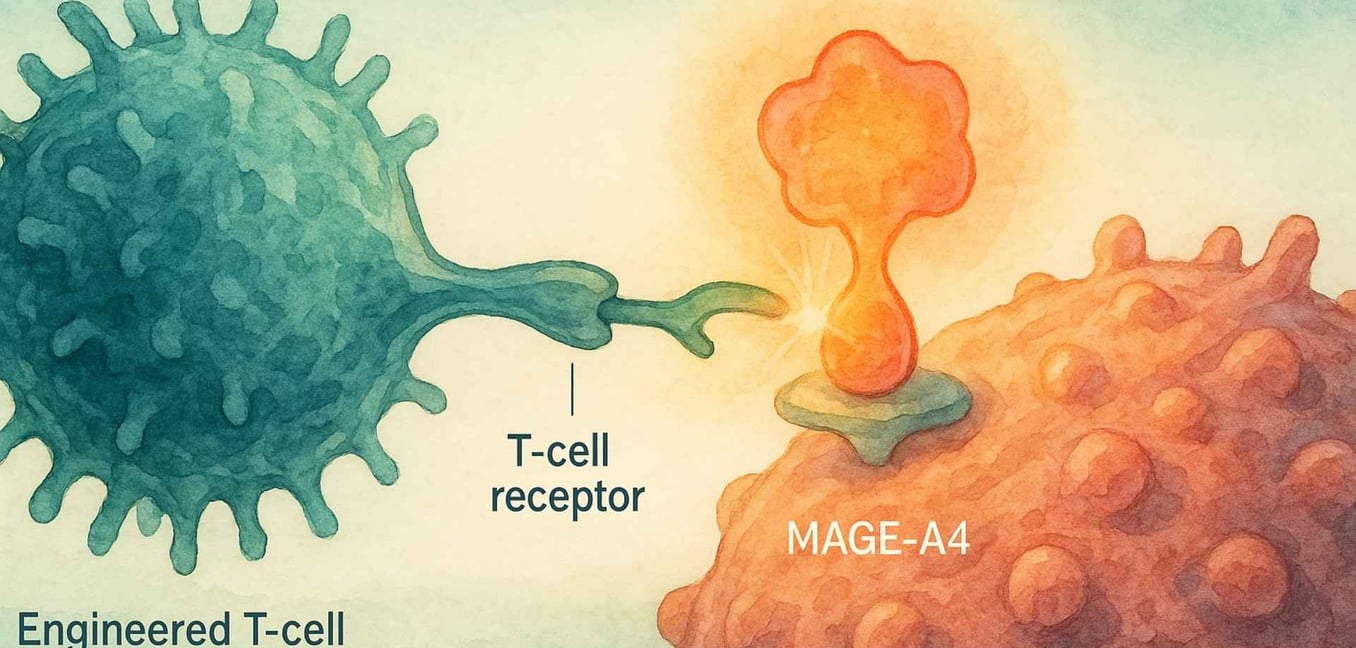
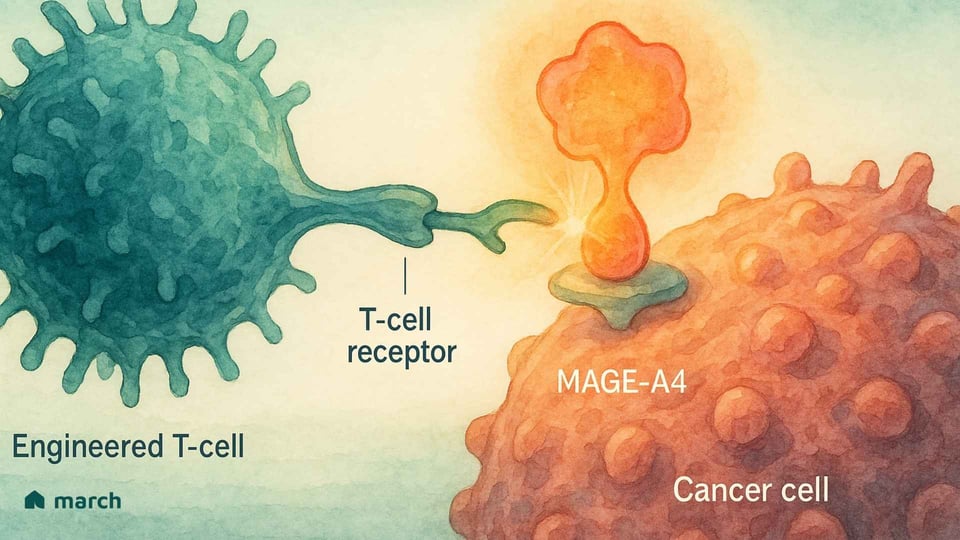
要真正理解Tecelra的重要性,我们必须从滑膜肉瘤独特的生物学开始。与许多拥有数百种不同基因突变的癌症不同,滑膜肉瘤通常是“突变沉默”的。[4] 超过95%的病例是由一个特定的基因事件驱动的:一个转座,其中18号染色体和X染色体的部分交换位置。[6][7] 这创造了一种强大而具破坏性的融合基因,称为 SS18-SSX。[6]
这种SS18-SSX融合蛋白本身并不导致癌症;相反,它劫持细胞内控制哪些基因被开启或关闭的内部机制。[6] 这种基因混乱的结果之一是癌细胞开始产生正常成人细胞不产生的蛋白质,包括一种名为 MAGE-A4 的蛋白质。[8]
MAGE-A4是一种“癌症-睾丸抗原”,意味着它通常只存在于像睾丸这样的免疫特权部位。[9] 当它出现在滑膜肉瘤细胞上时,它就像一面外国的旗帜,向免疫系统发出警告,表明某种东西不对劲。[8] 这就是Tecelra的优雅策略发挥作用的地方。
从CAR-T到TCR:针对无法触及的目标
我们中的许多人都听说过 CAR-T疗法,这对血液癌症来说是革命性的。[10] CAR-T细胞被设计成识别癌细胞表面的目标。然而,绝大多数驱动癌症的蛋白质,如MAGE-A4,位于细胞内,使其对CAR-T不可见。[20]
这就是 T-细胞受体(TCR)疗法 的作用。我们所有的细胞都使用一种称为HLA复合体的系统,持续向免疫系统展示其内部的蛋白质碎片。[13] 如果一个细胞是癌变的,它会在其表面展示癌蛋白的片段。TCR T细胞疗法通过工程化患者的T细胞,以识别这些非常特定的片段。[20]
Tecelra是第一个获得FDA批准的针对实体肿瘤的TCR疗法,是真正的里程碑成就。[11] 它之所以有效,是因为它同时解决了两个问题:
锁(目标):它给患者的T细胞提供了一种新的、高亲和力的TCR,旨在找到MAGE-A4蛋白片段。[13]
钥匙(握手):只有在由特定HLA分子HLA-A*02呈现时,它才能“看到”这一片段。[13]
这种两部分识别系统——MAGE-A4“锁”和HLA-A*02“钥匙”——使得治疗非常精准,同时也是高度个性化的。[13] 它只适用于拥有这两个生物标志物的患者。[14]
Tecelra过程:患者的活药之旅
理解科学是一回事,知道旅程实际包含什么又是另一回事。接受Tecelra的过程是密集的,并需要患者及其照顾者的重大承诺。这是一条将患者自身细胞转变为强大活药的多步骤路径。
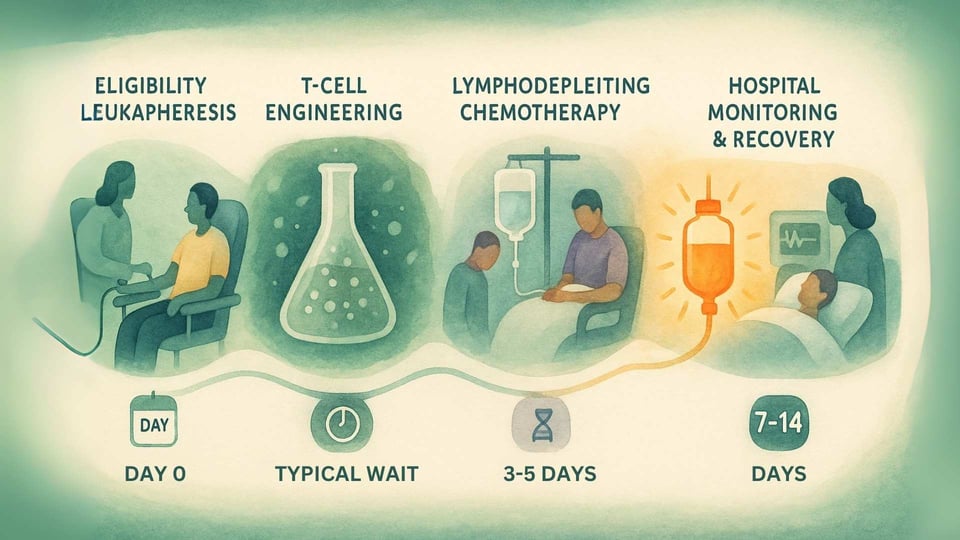
第一步:确认和采集(单采外周血淋巴细胞)
旅程从测试开始,以确保患者符合条件。这需要进行血液测试,以确认他们具有所需的HLA-A*02基因标记,并对肿瘤进行活检测试,以确认其表达MAGE-A4蛋白。[14] 一旦确认符合条件,患者将接受 单采外周血淋巴细胞,这是一种过滤其血液中的T细胞的非手术过程。[12]
第二步:制造等待
所收集的T细胞被冷冻并送往专门的制造设施。在这里,它们经历基因工程过程以成为Tecelra。[13] 这是一个复杂且细致的过程,在临床试验中,中位耗时为40天。[14] 在这个等待期间,患者的医生可能会建议进行“桥接疗法”,如化疗,以保持癌症的控制。[14]
第三步:准备身体(淋巴细胞清除)
在注射前的几天,患者将住院接受淋巴细胞清除化疗(通常是 氟达拉滨 和 环磷酰胺)。[14] 该化疗的目的不是杀死癌细胞,而是暂时减少体内现有免疫细胞的数量。[15] 这为新工程T细胞的附着、扩展和持久产生长期有效的效果创造了清晰和友好的环境。[15]
第四步:注射(零日)
在淋巴细胞清除后,患者通过一次静脉(IV)注射接受其个性化的Tecelra细胞。[14] 这一时刻常被称为“零日”,标志着他们新免疫系统与癌症斗争的开始。
第五步:密切监测和支持
注射后的时期是最关键的。因为该治疗旨在产生强大的免疫反应,患者必须在医院监测至少7天。[14] 他们还被建议在接下来至少4周内留在专门的治疗中心。考虑到后勤和经济负担,制造商提供了一项支持计划 AdaptimmuneAssist,可以帮助符合条件的患者承担旅行、住宿和其他个人费用。[16]
数据讲述的故事:SPEARHEAD-1试验的希望
多年来,这一非凡的科学是在实验室中研究的概念。但 SPEARHEAD-1 临床试验将其从理论变为现实,为44名已经经过中位三轮系统治疗的晚期滑膜肉瘤患者提供了切实的希望。[14][17] 这些患者是那些传统方案已不再有效的患者。结果发表在著名期刊《柳叶刀》上,成为了无限鼓励的来源。[14]
让我们来看看这些数字,因为它们讲述了一个强有力的希望故事:
有意义的反应(ORR):在这一重度预处理组中,43%的患者在一次注射Tecelra后看到他们的肿瘤缩小。[11][14] 这被称为总体反应率(ORR),是一个显著的数字,而后期治疗的反应率通常低于20%。
持久、持续的益处(DoR):对于那些对治疗有反应的患者,效果通常持久。反应的中位持续时间(DoR)为6.0个月。[14] 关键是,39%的反应者在一年后仍然看到这种益处,表明对于相当一部分患者具有持久的长期效果。[14]
曲线的“尾巴”(总体生存):或许最强有力的发现是接受Tecelra后患者的长期情况。对于整个滑膜肉瘤患者组,中位总体生存期(OS)约为17个月。[14] 但对于那些对治疗有反应的患者,中位OS尚未达到,估计70%的反应者在两年时仍然存活。[14] 这创造了研究人员所称的“生存曲线尾巴”。它表明对于一小部分患者,这种活药不仅仅是暂时的解决方案;它有潜力为癌症提供长期有效的防御,根本改变他们的前景。
对于一个等待了十多年新治疗方案的社区来说,这些结果代表了一个重要且富有情感的前进步伐。这种进步表明科学在倾听,而罕见疾病患者的需求正在推动创新。
未来的旅程:现实主义、责任和前景
我们与您共同走这条道路,怀抱希望与诚实。这是一种强大的治疗法,了解其显著的副作用至关重要。因为它旨在强力激活免疫系统,Tecelra伴随有美国黑框警告,警告两种主要的潜在致命毒性:[11]
细胞因子释放综合症(CRS):这是试验中最常见的严重副作用,在75%的患者中发生。[14] CRS是一种全身性炎症反应,可能导致高热、恶心、低血压和其他症状。虽然大多数病例是轻度到中度的,可以通过支持性护理和药物有效管理,但2%的患者经历了严重(3级或以上)的CRS。[14]
免疫效应细胞相关神经毒性综合症(ICANS):这是较少见的神经副作用,约有2%的患者,程度较轻。[14]
这些风险正是Tecelra只能在经过专业培训的授权治疗中心进行施治的原因。[18]
Tecelra的到来确实是一个新曙光,但我们知道这不是旅程的终点。有关高级疗法的对话必须包括获取和成本的挑战。报告的定价为727,000美元,确保公平获取对我们医疗系统来说是一项重大的伦理和实际挑战。[19] 作为倡导者,我们必须继续推动未来,让每个符合条件的人都能受益。
Tecelra的故事不仅仅是一种单一药物。它是科学不停进步的故事,打开了未来创新的大门。研究已经开始探索其他靶点,如NY-ESO-1抗原,以及设计得更为有效的下一代TCR。[20]
随着我们看到这一新前沿的展开,我们承诺为您提供清晰、可靠的信息。您的见解、您的经历以及您的希望是推动这一进步的动力。在这段探索之旅中,您并不孤单。
来源
Aytekin, M. N., et al. (2022). 骨科中的“伟大伪装者”:滑膜肉瘤。Cureus。
Orphanet. (n.d.). 滑膜肉瘤。
国家癌症研究所. (n.d.). 滑膜肉瘤治疗(PDQ®)–健康专业人员版。
King, D.M., et al. (2020). 滑膜肉瘤的综述。美国骨科医学会杂志。
Martin-Broto, J., et al. (2022). 帕唑帕尼和噻替派用于晚期滑膜肉瘤患者:一项真实世界研究。癌症。
Lagarde, P., et al. (2016). SS18-SSX融合癌蛋白。病理学杂志。
PathologyOutlines.com. (n.d.). 滑膜肉瘤 - 分子。
Saito, T., et al. (2023). MAGE-A4是滑膜肉瘤中的潜在治疗靶点。肿瘤学报告。
癌症研究所. (n.d.). 癌症-睾丸抗原。
国家癌症研究所. (n.d.). CAR T细胞疗法及其副作用。
美国食品药品监督管理局. (2024). FDA批准阿法米特基因自体细胞的加速批准。
国家癌症研究所. (n.d.). 单采外周血淋巴细胞。NCI癌症术语词典。
Adaptimmune. (n.d.). 我们的技术。
D'Angelo, S. P., et al. (2024). 阿法米特基因自体细胞对晚期滑膜肉瘤的治疗(SPEARHEAD-1)。柳叶刀。
Jain, T., et al. (2019). CAR T细胞疗法:淋巴细胞清除的作用。《血液学专家》。
Adaptimmune. (n.d.). AdaptimmuneAssist。
D'Angelo, S. P., et al. (2021). 阿法米特基因自体细胞用于晚期滑膜肉瘤或粘液样/圆细胞脂肪肉瘤。ASCO Post。
Adaptimmune. (n.d.). 授权治疗中心。
Leo, L. & Sunny, S.E. (2024). 美国FDA批准Adaptimmune的基因疗法治疗罕见癌症。路透社。
Ma, S., et al. (2021). 针对实体肿瘤的T细胞受体工程T细胞疗法的当前格局。《血液学与肿瘤学杂志》。